Pada umumnya, unsur-unsur di alam ditemukan tidak dalam keadaan bebas (kecuali pada suhu tinggi). Unsur-unsur tersebut ditemukan sebagai suatu kelompok-kelompok atom berikatan yang disebut sebagai molekul. Diketahui ada 3 jenis ikatan kimia yaitu ikatan ion, kovalen, dan logam. Kelompok-kelompok atom atau molekul yang berikatan secara energi memiliki keadaan/kondisi yang lebih stabil dibanding unsur-unsur dalam keadaan bebas.
Pengertian ikatan kimia sendiri adalah suatu ikatan yang memiliki gaya untuk menahan atom–atom dalam molekul. Ikatan kimia yang terbentuk dapat berupa ikatan ion atau ikatan kovalen. Ikatan kimia terbentuk karena unsur-unsur memiliki kecenderungan membentuk struktur elektron stabil. Struktur elektron stabil yang dimaksud yaitu struktur elektron gas mulia atau Golongan VIII A, di mana atom memiliki elektron valensi sebanyak 2 atau 8.
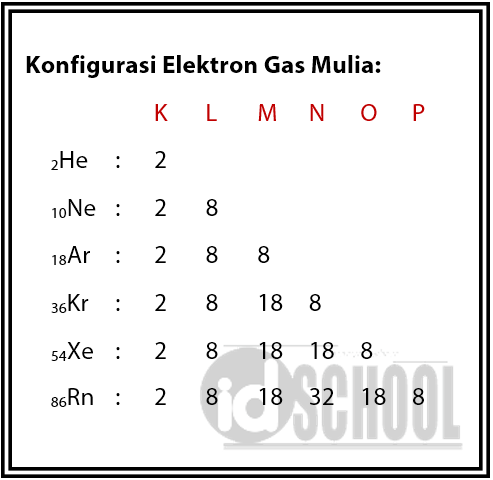
Kecenderungan atom–atom untuk memiliki struktur atau konfigurasi elektron seperti gas mulia dengan 8 elektron pada kulit terluar disebut kaidah oktet. Sementara untuk atom-atom yang mempunyai kecenderungan untuk memiliki konfigurasi elektron seperti gas helium dengan 2 elektron pada kulit terluar disebut kaidah duplet. Agar dapat mencapai struktur elektron seperti gas mulia, antar unsur akan membentuk ikatan ion atau ikatan kovalen.
Apa perbedaan dari setiap jenis ikatan kimia ini? Melalui halaman ini, idschool akan mengulas apa dan bagaimana ketiga jenis ikatan kimia yang dibentuk suatu molekul.
Table of Contents
Mengenal Struktur Lewis
Sebelum mempelajari ikatan kimia yang meliputi ikatan ion, ikatan kovalen, dan ikatan logam sebaiknya sobat idschool mengenal apa itu yang disebut struktur lewis. Bentuk rumus/struktur lewis berupa lambang atom yang di sekelilingnya dikeliling oleh elektron sebanyak jumlah elektron valensi suatu atom. Elektron valensi pada struktur Lewis biasa digambarkan dengan bulatan (·) atau tanda silang (x) yang mengeliling lambang atom secara berpasangan jika memungkinkan.
Contohnya adalah atom H (nomor atom 1) memiliki elektron valensi sebanyak 1 sehingga lambang titik lewis digambarkan melalui atom H dan satu buah bulatan.
Contoh lain pada atom N yang memiliki elektron valensi 5 maka lambang titik lewis digambarkan sebagai huruf N besar yang dikelilingi 5 bulatan. Lambang titik lewis akan mempermudah sobat idschool dalam memahami ikatan kimia suatu molekul.
Untuk atom oksigen dengan nomor atom 8 memiliki konfugurasi elektron 8O = 2, 6 yang berarti memiliki elektron valensi = 6. Sehingga, struktur lewis digambarkan oleh dua pasangan elektron berikatan dan 2 buah elektron bebas. Untuk atom klorin (Cl) dengan nomor atom 17 memiliki konfugurasi elektron 17Cl = 2, 8, 7 yang berarti memiliki elektron valensi sebanyak 7. Bentuk struktur lewis untuk atom klorin digambarkan oleh tiga pasangan elektron berikatan dan sebuah elektron bebas.

Baca Juga: 5 Hukum Dasar Kimia
3 Jenis Ikatan Kimia
Penjelasan apa dan bagaiman ikatan kimia untuk ikatan ion (ikatan elektrovalen), ikatan kovalen, dan ikatan logam diulas lebih banyak pada masing-masing penjelasan di bawah.
1) Ikatan Ion [Ikatan Elektrovalen]
Ikatan kimia pertama yang akan dibahas adalah ikatan ion yaitu ikatan yang terbentuk akibat adanya serah terima (melepas/menerima) elektron oleh atom-atom yang berikatan. Atom yang melepaskan elektron akan membentuk ion positif (kation), sedangkan atom yang menerima elektron akan berubah menjadi ion negatif (anion). Selanjutnya terjadilah gaya elektrostatik atau tarik-menarik antara ion positif dan ion negatif sehingga membentuk ikatan yang disebut sebagai ikatan ion.
Ikatan ion dapat terbentuk antara unsur/atom dengan ketentuan berikut.
- Ion positif (kation) dengan ion negatif (aniom)
- Atom-atom berenergi potensial ionisasi kecil dengan atom-atom berafinitas elektron besar:
*atom-atom golongan IA dengan unsur golongan VII A
*atom-atom golongan IIA dengan atom-atom unsur golongan VIA - Atom-tom dengan keelektronegatifan kecil dengan atom-atom yang mempunyai keelektronegatifan besar.
Senyawa yang memiliki ikatan ion disebut senyawa ionik yang biasanya terbentuk antara atom-atom unsur logam dan non logam. Atom-atom membentuk ikatan ion karena masing-masing atom ingin mencapai keseimbangan atau kestabilan seperti struktur elektron gas mulia.
Sifat-sifat senyawa dengan ikatan ion sebagai berikut:
- Pada suhu kamar berwujud padat
- Struktur kristalnya keras (permukaannya keras dan sukar digores) tetapi rapuh
- Mempunyai titik didih dan titik leleh tinggi
- Larut dalam pelarut air (pelarut polar) tetapi tidak larut dalam pelarut organik (pelarut non polar)
- Tidak menghantarkan listrik pada fase padat (karena partikel-partikel ionnya terikat kuat pada kisi sehingga tidak ada elektron yang bebas bergerak) tetapi pada fase cair (lelehan) dan larutannya menghantarkan listrik.
Contoh: ikatan ion terjadi antara Natrium (Na) dengan nomor atom 11 dengan Clor (Cl) dengan nomor atom 17 membentuk senyawa NaCl.
Atom Na memiliki atom valensi sebanyak 1 dan atom Cl memiliki atom valensi sebanyak 7. Untuk memiliki struktur elektron stabil seperti pada struktur elektron gas mulia. Atom Na melepas 1 elektron sehingga memiliki konfigurasi 2, 8 dan membentuk Na+. Atom Cl menerima 1 elektron sehingga memiliki konfigurasi 2, 8, 8 dan membentuk Cl–. Na+ + Cl– membentuk ikatan ion NaCl (natrium klorida).

Contoh ikatan ion lainnya terdapat pada molekul seperti MgO, CaF2, Li2O, AlF3, dan lain sebagainya.
Baca Juga: Konfigurasi Elektron Model Bohr dan Mekanika Kuantum
2) Ikatan Kovalen
Ikatan kovalen adalah ikatan yang terjadi antara unsur non logam dengan unsur non logam ditandai dengan cara pemakaian bersama pasangan elektron. Pasangan elektron yang dipakai bersama disebut Pasangan Elektron Ikatan (PEI). Sedangkan pasangan elektron valensi yang tidak terlibat dalam pembentukan ikatan kovalen disebut pasangan elektron bebas (PEB).
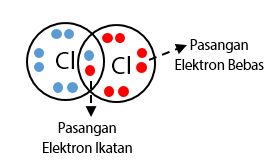
Sebuah pasangan elektron ikatan bisa digantikan dengan sebuah garis yang disebut tangan ikatan. Jumlah tangan dapat menggambarkan jumlah ikatan dalam suatu senyawa kovalen.

Berdasarkan jumlah PEI ikatan kovalen dibedakan menjadi ikatan kovalen tunggal, ikatan kovalen rangkap dua, dan ikatan kovalen rangkap tiga. Selain itu terdapat juga ikatan kovalen koordinasi, dimana ikatan kovalen yang memiliki jumlah PEI berasal dari salah satu atom yang berikatan. Berdasarkan kepolaran ikatan, ikatan kovalen dibagi menjadi 2 jenis yaitu ikatan kovalen polar dan non polar.
Baca lebih lanjut: Macam – Macam Ikatan Kovalen
Jenis ikatan pada molekul H2 adalah ikatan kovalen tunggal. Ikatan pada molekul O2 terdiri dari dua atom oksigen sehingga merupakan ikatan kovalen rangkap dua. Sedangkan pada molekul N2 terdapat tiga ikatan kovalen yang disebut ikatan kovalen rangkap tiga.
Ikatan kovalen dapat terjadi pada atom sejenis dan berbeda jenis. Contoh ikatan kovalen pada atom sejenis adalah H2, N2, O2, Cl2, F2, Br2, dan I2. Contoh ikatan kovalen pada atom berbeda jenis adalah HH2O, COH2, dan lain sebagainya.

Jumlah elektron valensi yang digunakan untuk berikatan tergantung pada kebutuhan tiap atom untuk mencapai konfigurasi elektron seperti gas mulia dengan kaidah duplet atau kaidah oktet.
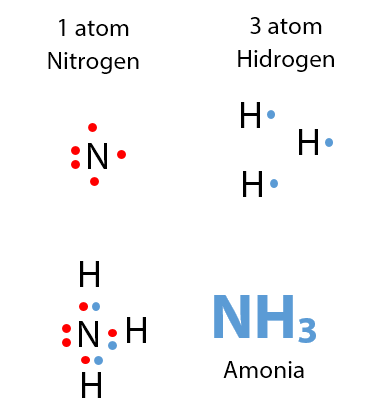
Contoh ikatan kovalen terdapat pada pembentukan ikatan antara 1H dengan 7N membentuk NH3 (amonia).
Atom nitrogen memerlukan tiga elektron untuk mendapatkan susunan elektron gas mulia, sedangkan setiap atom hidrogen memerlukan sebuah elektron untuk mempunyai konfigurasi elektron seperti gas helium. Oleh karena itu, setiap atom nitrogen memerlukan tiga atom hidrogen.
Sifat-sifat dengan ikatan senyawa kovalen sebagai berikut.
- Pada suhu kamar umumnya berupa gas (misal H2, O2, N2, Cl2, CO2), cair (misalnya: H2O dan HCl), ataupun berupa padatan.
- Titik didih dan titik lelehnya rendah, karena gaya tarik-menarik antarmolekulnya lemah meskipun ikatan antaratomnya kuat.
- Larut dalam pelarut nonpolar dan beberapa di antaranya dapat berinteraksi dengan pelarut polar.
- Larutannya dalam air ada yang menghantar arus listrik (misal HCl) tetapi sebagian besar tidak dapat menghantarkan arus listrik, baik padatan, leburan, atau larutannya.
Sobat idschool dapat memprediksi ikatan kimia melalui konfigurasi elektron dari atom unsur tersebut (melalui banyaknya elektron valensi). Dari sana akan diketahui jumlah kekurangan elektron masing-masing unsur untuk mencapai kaidah oktet atau kaidah duplet.
Baca Juga: Cara Menentukan Golongan dan Periode Suatu Atom
3) Ikatan Logam
Jenis ikatan kimia berikutnya adalah ikatan logam yang dijelaskan melalui teori lautan elektron yaitu gaya tarik antara muatan positif dari ion-ion logam (kation logam) dengan muatan negatif yang terbentuk dari elektron -elektron valensi dari atom-atom logam.
Sehingga dapat dikatakan bahwa ikatan logam adalah ikatan kimia yang terbentuk akibat penggunaan bersama elektron-elektron valensi antar atom-atom logam. Contoh ikatan logam terdapat pada logam besi, seng, dan perak.
Contoh terjadinya ikatan logam:
Tempat kedudukan elektron valensi dari suatu atom besi (Fe) dapat saling tumpang tindih dengan tempat kedudukan elektron valensi dari atom-atom Fe yang lain. Tumpang tindih antar elektron valensi ini memungkinkan elektron valensi dari setiap atom Fe bergerak bebas dalam ruang di antara ion – ion Fe+ membentuk lautan elektron. Karena muatannya berlawanan (Fe2+ dan 2 e–) maka terjadi gaya tarik – menarik antara ion – ion Fe+ dan elektron-elektron bebas ini. Akibatnya terbentuk ikatan yang disebut ikatan logam.
Adanya ikatan logam menyebabkan logam bersifat:
- Pada suhu kamar berwujud padat, kecuali Hg
- Keras tapi lentur/dapat ditempa
- Mempunyai titik didih dan titik leleh yang tinggi
- Penghantar listrik dan panas yang baik
- Mengilap
Sekian ulasan materi ikatan kimia yang meliputi ikatan ion, ikatan kovalen, dan ikatan logam. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Cara Menentukan Jumlah Proton, Elektron, dan Neutron pada Suatu Atom
