Hidrolisis berasal dari kata hidro (air) dan lisis (penguraian) yaitu pemecahan senyawa kimia melalui penambahan air. Cara menghitung dan rumus pH larutan garam bergantung dari asal larutan asam/basa yang membentuknya. Larutan garam yang dilarutkan dalam air memiliki dua kemungkinan yaitu tidak mengalami hidrolisis dan mengalami hidrolisis.
Larutan asam kuat dengan basa kuat tidak mengalami hidrolisis, sedangkan asam lemah dengan basa lemah mengalami hidrolisis sempurna (total). Contoh garam yang tidak mengalami hidrolisis adalah natrium klorida (NaCl) dan Kalium Sulfat (K2SO4). Contoh garam yang mengalami hidrolisis sempurna adalah adalah ammonium sianida (NH4CN) dan magnesium karbonat (MgCO3). Selain itu juga terdapat hidrolisis sebagian yang terjadi pada garam dari larutan asam lemah dengan basa kuat atau asam kuat dengan basa lemah. Contoh hidrolisis sebagian terjadi pada NH4Cl (ammonium klorida) dan CH3COONa (natrium asetat/etanoat).
Bagaimana cara menghitung pH larutan hidrolisis? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: 3 Konsep Teori Larutan Asam Basa (Arreheinus, Bronsted-Lowry, dan Lewis)
Konsentrasi H+ dan OH– pada Hidrolisis
Pada hidrolisis, komponen garam (kation dan anion) yang berasal dari asam lemah atau basa lemah bereaksi dengan air membentuk ion H3O+ (H+) atau OH–. Jika hidrolisis menghasilkan ion H3O+ maka larutan bersifat asam. Sedangkan pada hidrolisis yang menghasilkan ion OH– maka larutan bersifat basa.
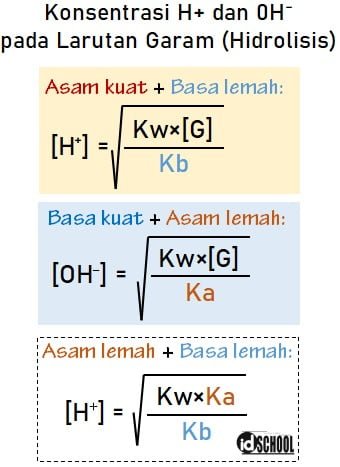
Langkah pertama dalam perhitungan pH larutan garam adalah mengetahui konsentrasi H+ atau OH–. Di mana ada tiga bentuk rumus yang dapat digunakan pada perhitungan H+ atau OH–. Penggunaan rumus H+ atau OH– disesuaikan dengan larutan asam/basa pembentuk garam.
Rumus konsentrasi H+ dan OH– pada hidrolisis meliputi tiga bentuk persamaan di bawah.
Keterangan:
[H+] = konsentrasi H+
Kw = tetapan kesetimbangan air
Kb = tetapan kesetimbangan basa
[OH–] = konsentrasi OH–
Ka = tetapan kesetimbangan asam
Garam yang terbentuk dari asam kuat dan basa lemah menggunakan rumus [H+]. Garam yang terbentuk dari asam lemah dan basa kuat menggunakan rumus [OH–]. Selain itu, ada satu lagi bentuk rumus [H+] berbeda yang digunakan pada pembentukan garam dari asam lemah dan basa lemah.
Setelah mendapatkan besar konsentrasi H+ dan OH– langkah selanjutnya adalah menghitung pH larutan garam (atau pOH larutan). Di mana harga pH secara umum dapat dihitung melalui persamaan pH = –log[H+] dan pOH = –log[OH–].
Baca Juga: Rumus Tetapan Kesetimbangan Kc dan Kp
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal pH Larutan Garam
Sebanyak 1,32 gram kristal (NH4)2SO4 dilarutkan dalam air sehingga volumenya menjadi 1 L. Jika diketahui Kb NH4OH =10–5 maka pH larutan yang terbentuk sebesar …. (Ar N=14; S= 32; H = 1; O=16)
A. 8,5 + 1/2log 2
B. 8,5 – log √2
C. 5,5 + log √2
D. 5,5 – 1/2log 2
E. 5,5 – log 2
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh infomrasi-informasi seperti berikut.
- Massa (NH4)2SO4: Gr = 1,32 gram
- Volumen = 1 L
- Kb NH4OH =10–5
- Molekul relatif (NH4)2SO4:
- Mr (NH4)2SO4 = 2×Ar N + 8×Ar H + Ar S + 4×Ar O
Mr (NH4)2SO4 = 2×14 + 8×1 + 32 + 4×16 = 132
Menghitung konsentrasi (NH4)2SO4:
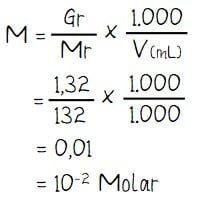
Reaksi ionisasi:
(NH4)2SO4 (aq) → 2 NH4+ (aq) + SO42– (aq)
Perhatikan bahwa ion NH4+ yang terbentuk ada sebanyak 2, sehingga konsentrasi H+ larutan dapat dihitung seperti cara di bawah.
Konsentrasi H+ dari garam (NH4)2SO4:
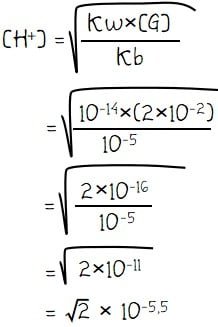
Menghitung pH larutan yang terbentuk:
pH = –log[H+]
pH = –log[√2 × 10–5,5]
= 5,5 – log√2
= 5,5 – 1/2log 2
Jadi, pH larutan yang terbentuk sebesar 5,5 – 1/2log 2.
Jawaban: D
Contoh 2 – Soal pH Larutan Garam
Sebanyak 50 mL larutan NH3 0,02 M dicampurkan dengan 50 mL larutan HCl 0,02 M. Bila Kb NH3 = 2×10–5 maka pH campuran larutan tersebut adalah ….
A. 6 – 1/2log 5
B. 6 + 1/2log 5
C. 8 – log √5
D. 8 + log √5
E. 10 – 1/2log 5
Pembahasan:
Menentukan mol NH3 dan HCl:
- Jumlah mol NH3:
- n = M×V
- n = 0,02×50 = 1 mmol
- Jumlah mol HCl:
- n = M×V
- n = 0,02×50 = 1 mmol
Stokiometri:
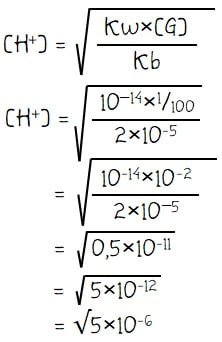
Menghitung pH larutan garam:
pH = –log[H+]
pH = –log[√5×10–6] = 6 – log √5
Jadi, pH campuran larutan tersebut adalah pH = 6–log √5 = 6 – log 5½ = 6 – 1/2log 5.
Jawaban: A
Baca Juga: Apa Itu Kesetimbangan Kimia?
Contoh 3 – Soal pH Larutan Garam
Diketahui Ka NH4OH = 10–5 dan pH larutan garam (NH4)2SO4 adalah 5 – log 2 (Mr = 132). Massa yang terlarut dalam 500 ml larutan adalah ….
A. 1,32 gram
B. 3,23 gram
C. 6,23 gram
D. 10,32 gram
E. 11,23 gram
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Ka NH4OH = 10–5
- pH larutan garam (NH4)2SO4 = 5 – log 2
- Mr (NH4)2SO4 = 132)
- Volume larutan: V = 500 ml
Menghitung konsentrasi H+ dalam larutan:
pH = –log[H+]
5 – log 2 = –log[H+]
[H+] = 2×10–5
Menghitung konsentrasi NH4+:

Dari hasil perhitungan diperoleh bahwa molaritan NH4+ sama dengan 0,4 M. Sehingga jumlah mol NH4+ adalah n = M×V = 0,4×500 mL = 20 mmol. Selanjutnya, jumlah mol untuk (NH4)2SO4 dapat ditentukan melalui cara berikut.
Diperoleh bahwa jumlah mol larutan garam (NH4)2SO4 sama dengan 10 mmol = 0,01 mol. Selanjutnya, masa (NH4)2SO4 dapat dihitung seperti cara di bawah.
Massa (NH4)2SO4:
m = mol × Mr (NH4)2SO4
m = 0,01 × 132 = 1,32 gram.
Jadi, massa yang terlarut dalam 500 ml larutan adalah 1,32 gram.
Jawaban: A
Demikianlah tadi ulasan rumus pH larutan garam (hidrolisis) dan contoh cara menghitungnya. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Hubungan Derajat Ionisasi dengan Kekuatan Larutan Asam/Basa