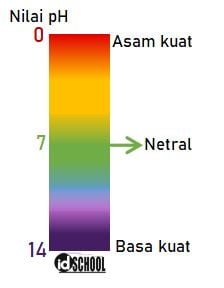
Larutan asam dan basa memiliki tingkat keasaman/kebasaan yang dinyatakan dalam nilai atau harga pH. Cara menghitung harga pH larutan diperoleh melalui operasi hitung logaritma untuk bentuk persamaan dasar. Sehingga kemampuan dasar melakukan operasi hitung logaritma dibutuhkan untuk menentukan harga pH. Harga pH suatu larutan asam dan basa memiliki rentang nilai nilai dari 1 sampai dengan 14 (0<pH<14).
Larutan asam memiliki tingkat kemampuan untuk mengionisasi ion hidrogen (H+) yang dinyatakan dalam keasaman atau Power of Hidrogen (pH). Sedangkan larutan basa memilki kemampuan menghasilkan ion OH– yang dinyatakan dalam nilai Power of Hydroxide (pOH). Antara pH dan pOH memiliki hubungan yang dinyatakan dalam persamaan pH + pOH = 14. Larutan asam memiliki rentang harga 0<pH<7 dan larutan basa memiliki rentang harga 7<pH<14. Larutan dengan sifat netral memiliki harga pH = 7.
Apa rumus yang digunakan untuk menghitung harga pH? Bagaimana cara menghitung harga pH larutan? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah
Baca Juga: Indikator Asam Basa
pH Larutan Asam dan Basa Kuat
Harga pH pada suatu larutan asam dipengaruhi oleh besar konsentrasi ion H+ yang dihasilkan. Di mana, harga pH larutan asam sama dengan –log konsentrasi ion H+ (pH = – log [H+]).
Sedangkan harga pH pada larutan basa dapat dicari dengan menghitung pOH terlebih dahulu. Nilai atau harga pOH pada larutan basa sama dengan –log konsentrasi ion OH– (pOH = –log [OH–]). Setelah mendapatkan nilai pOH, pH larutan basa dapat dihitung melalui persamaan pH = 14 – pOH.
Perhatikan bahwa perhitungan nilai pH dan pOH larutan membutuhkan pengetahuan dan kemampuan logaritma. Namun tidak perlu khawatir karena hanya melibatkan bentuk dasar dari operasi logaritma dengan basis sama dengan 10 (biasanya tidak ditulis).
Sebagai contoh, perhatikan cara menghitung harga pH larutan pada permasalahan sederhana berikut.
Soal 1: Tentukan harga pH larutan H2SO4 0,01 M!
Jadi, harga pH larutan H2SO4 0,01 M adalah pH = 2 – log 2.
Baca Juga: Cara Menentukan Arah Pergeseran Reaksi Kesetimbangan
pH Larutan Asam dan Basa Lemah
Senyawa asam/basa lemah merupakan larutan elektrolit lemah yang dapat terionisasi sebagian di dalam air. Tingkat atau derajat ionisasi (ɑ) larutan elektrolit dinyatakan berada antara 0<ɑ<1. Besar derajat ionisasi ini mempengaruhi nilau tetapan kesetimbangan larutan (K). Di mana tetapan kesetimbangan pada larutan asam/basa lemah akan mempengaruhi harga pH larutan asam/basa lemah.
Cara menghitung harga pH larutan asam/basa lemah sama dengan perhitungan pH larutan asam/basa kuat. Di mana harga pH larutan dipengaruhi besar konsentrasi H+ atau OH–. Namun pada larutan asam/basa lemah, besar konsentrasi H+ atau OH– melibatkan tetapan kesetimbangan Ka (pada larutan asam lemah) dan Kb (pada larutan basa lemah).
Persamaan konsetrasi H+ pada larutan asam lemah sama dengan akar dari perkalian Ka dan Ma (molaritas asam lemah). Dan persamaan konsetrasi OH– pada larutan basa lemah sama dengan akar dari perkalian Kb dan Mb (molaritas basa lemah). Sehingga harga pH dan pOH larutan asam/basa lemah dapat dinyatakan melalui persamaan di bawah.
Contoh cara menghitung harga pH pada larutan asam/basa lemah dapat dilihat seperti pesoalan sederhana berikut.
Soal 2: Larutan amonia dibuat dengan cara melarutkan 4,48 liter gas NH3 (STP) hingga diperoleh volume larutan sama dengan 2 liter. Jika Kb NH3 = 10–5 maka berapakah harga pH larutan amonia yang dihasilkan?
Penyelesaian:
Baca Juga: 3 Konsep Teori Asam Basa
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pengatuhan bahasan di atas. Setiap soal yang diberikan lengkap dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Harga pH Larutan Ba(OH)2
Sebanyak 17,1 gram Ba(OH)2 dilarutkan dalam air sehingga volume larutan menjadi 500 mL. Harga pH larutan Ba(OH)2 yang terbentuk adalah .… (Ar Ba = 137; O = 16; dan H = 1)
A. log 0,4
B. 1 – log 4
C. log 4 – 1
D. 13 – log 4
E. 13 + log 4
Pembasahan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi berikut.
- Massa Ba(OH)2: Gram = 17,1 gr
- Volume larutan: V = 100 mL
- Mr Ba(OH)2 = Ar Ba + 2×Ar O + 2×Ar H
Mr Ba(OH)2 = 137 + 2×16 + 2×1 = 171
Menghitung molaritas Ba(OH)2:
Reaksi ionisasi Ba(OH)2:
Ba(OH)2 (aq) → Ba2+ (aq) + 2OH– (aq)
Dari rekasi tersebut dapat disimpulkan bawa [OH–] = 2×[Ba(OH)2] = 2×0,2 M = 0,4 M = 4×10–1 M. Selanjutnya dapat dihitung pOH larutan Ba(OH)2 seperti berikut.
pOH = –log[OH–]
pOH = –log[4×10–1]
= –log4 – log 10–1
= –log4 + 1
Menghitung pH:
pH = 14 – pOH
pH = 14 – (–log4 + 1) = 13 + log 4
Jadi, harga pH larutan Ba(OH)2 yang terbentuk adalah 13 + log4.
Jawaban: E
Contoh 2 – Harga pH Larutan CH3COOH
Sebanyak 10 mL larutan CH3COOH 0,1 M diencerkan hingga volumenya 100 mL. Diketahui Ka CH3COOH = 1×10–5 maka harga pH larutan CH3COOH sesudah diencerkan adalah ….
A. 3
B. 3,5
C. 7
D. 10,5
E. 11
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi berikut.
- Volume awal: V1 = 10 mL
- Volume akhir: V2 = 100 mL
- Konsentrasi awal: 0,1 M
- Tetapan setimbang CH3COOH: Ka CH3COOH = 1×10–5
Menghitung konsentrasi CH3COOH setelah diencerkan (M2):
M1×V1 = M2×V2
0,1×10 = M2×100
1 = 100M2
M2 = 1/100 = 0,01 = 10–2 M
Dari hasil perhitungan dapat diperoleh molaritas CH3COOH setelah diencerkan adalah M2 = 10–2 M. Konsentrasi ion H+ dapat diperoleh seperti perhitungan di bawah.
Harga pH larutan CH3COOH sesudah diencerkan:
pH = –log[H+]
pH = –log(10–3,5) = 3,5
Jawaban: B
Contoh 3 – Harga pH Larutan CH3COOH
Larutan 100 cm3 H2SO4 memiliki nilai pH = 2. Jika larutan tersebut diencerkan hingga volume larutan menjadi 1.000 cm3 maka harga pH larutan H2SO4 yang terbentuk adalah ….
A. 1
B. 2
C. 3
D. 4
E. 5
Pembahasan:
Berdasarkan informasi yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Volume awal: V1 = 100 cm3
- pH larutan H2SO4 awal: pH = 2
- Volume akhir: V2 = 1.000 cm3
Menentukan konsentrasi H+ sebelum diencerkan:
pH = –log[H+]
2 = –log[H+]
[H+] = 10–2
Sehingga, konsentrasi H2SO4 dapat diperoleh seperti cara berikut.
Diperoleh bahwa konsentrasi H2SO4 sebelum diencerkan adalah 1/2×10-2 M = 5 ×10-3. Dengan demikian dapat dicari konsentarasi H2SO4 setelah diencerkan seperti cara berikut.
M1×V1 = M2×V2
5 ×10-3×100 = M2×10.00
5 ×10-1 = 1.000M2
M2 = 5 ×10-4 M
Konsentrasi H+ setelah diencerkan:
[H+] = 2×[H2SO4]
[H+] = 2×5×10-4 M = 10-3 M
Menghitung pH larutan H2SO4:
pH = –log[H+]
pH = –log[10-3] = 3
Jadi, harga pH larutan H2SO4 yang terbentuk adalah 3.
Jawaban: C
Demikianlah tadi ulasan cara menghitung harga pH larutan asam dan basa. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Kumpulan Rumus Konsentrasi Larutan (+Contoh Soal dan Pembahasan)