Reaksi Redoks adalah singkatan dari dua jenis reaksi kimia yaitu reaksi reduksi dan reaksi oksidasi. Pada awalnya, reaksi redoks dipandang sebagai hasil dari perpindahan atom oksigen dan hidrogen. Konsep redoks tersebut disebut sebagai teori klasik yang mengatakan bahwa oksidasi adalah proses penangkapan oksigen dan kehilangan hidrogen.
Konsep reaksi redoks kemudian berkembang yang kemudian disebut teori modern. Dalam teori tersebut dijelaskan konsep redoks sebagai proses oksidasi dan reduksi yang tidak hanya dilihat dari penangkapan oksigen dan hidrogen, melainkan dipandang sebagai proses perpindahan elektron dari zat yang satu ke zat yang lain.

Contoh reaksi kimia dalam kehidupan sehari-hari yang termasuk dalam reaksi reduksi dan oksidasi adalah peristiwa perkaratan pada logam, pembakaran, pembusukan oleh mikroba, fotosintesis pada tumbuhan, dan metabolisme dalam tubuh.
Apa itu reaksi reduksi? Apa itu reaksi oksidasi? Apa itu reaksi redoks? Bagaimana penjelasan masing-masing dari ketiga konsep reaksi redoks tersebut?
Melalui halaman ini, sobat idschool akan mempelajari reaksi redoks dalam tiga konsep. Pertama adalah konsep redoks berdasarkan pengikatan atau pelepasan oksigen. Kedua adalah konsep reaksi redoks berdasarkan pengikatan atau pelepasan elektron. Dan yang ketiga adalah konsep reaksi redoks berdasarkan perubahan bilangan oksidasi.
Table of Contents
- 1) Reaksi Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen
- 2) Reaksi Redoks Berdasarkan Pengikatan dan Pelepasan Elektron
- 3) Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
1) Reaksi Redoks Berdasarkan Pengikatan dan Pelepasan Oksigen
Konsep reaksi oksidasi dan reduksi pertama yang diperkenalkan adalah konsep reaksi redoks yang dilihat dari pengikatan atau pelepasan oksigen. Diperkenalkanlah konsep reaksi oksidasi yang didefinisikan sebagai reaksi penggabungan/pengikatan suatu zat dengan oksigen. Sedangkan kondisi sebaliknya yaitu reaksi pelepasan oksigen oleh suatu zat disebut reaksi reduksi.
Contoh reaksi oksidasi terjadi pada reaksi atom C mengikat O2 membentuk CO2. Menurut konsep redoks berdasarkan pengikatan dan pelepasan oksigen, reaksi tersebut merupakan reaksi oksidasi. Alasannya karena terdapat pengikatan oksigen di dalam reaksi.
Contoh beberapa reaksi oksidasi berdasarkan konsep pengikatan oksigen dapat dilihat seperti berikut.

Perhatikan contoh beberapa reaksi yang diberikan di atas bahwa Fe, S, dan SO2 berturut – turut menjadi Fe2O3, SO2, dan SO3 setelah mengikat oksigen. Sehingga dapat dikatakan bahwa C, Fe, S, dan SO2 telah mengalami reaksi oksidasi.
BacaJuga: Ikatan Kimia (Ion, Kovalen, Logam)
Reaksi reduksi terjadi pada reaksi SO3 yang melepaskan oksigen (O2) dan membentuk SO2. Contoh beberapa reaksi reduksi berdasarkan konsep pengikatan oksigen dapat dilihat seperti berikut.
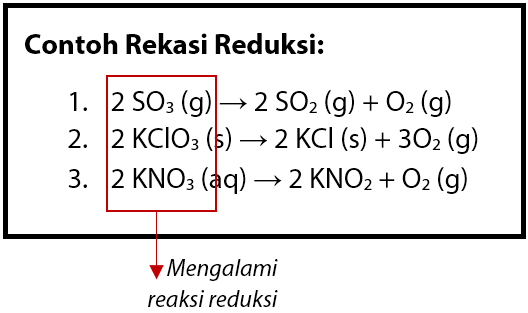
Perhatikan reaksi reduksi nomor 2 dan 3, terlihat bahwa KClO3 dan KNO3 masing – masing melepaskan oksigen menjadi KCl dan KNO2. Sehingga KClO3 dan KNO3 di sini mengalami reaksi reduksi.
Pada reaksi termit menghasilkan besi cair yang sering digunakan untuk mengelas benda – benda dari besi. Persamaan untuk reaksinya diberikan seperti berikut.
2 Al(s) + Fe2O3 (s) → 2 Fe(l) + Al2O3 (s)
Al mengikat oksigen membentuk Al2O3 berarti Al mengalami oksidasi. Fe2O3 melepaskan oksigen membentuk Fe. Jadi dapat dikatakan bahwa senyawa Fe2O3 mengalami reduksi. Pada reaksi termit tersebut oksidasi dan reduksi terjadi bersamaan, reaksi seperti ini disebut reaksi redoks.
Baca Juga: Larutan Elektrolit dan Larutan Non Elektrolit
2) Reaksi Redoks Berdasarkan Pengikatan dan Pelepasan Elektron
Perhatikan persamaan reaksi berikut: Na(s) + S(s) → Na2S (s)
Reaksi di atas tidak melibatkan gas oksigen, maka konsep redoks berdasarkan pengikatan dan pelepasan oksigen yang sudah dibahas di atas tidak dapat digunakan.
Untuk menentukan reaksi redoks yang tepat sesuai reaksi di atas adalah konsep redoks berdasarkan pengikatan dan pelepasan elektron. Konsep redoks ini muncul kemudian setelah konsep redoks berdasarkan pelepasan/pengikatan oksigen diperkenalkan.
Definisi konsep reduksi dan konsep oksidasi menurut konsep redoks berdasarkan pelepasan/pengikatan elektron diberikan seperti berikut.
- Reaksi oksidasi adalah reaksi pelepasan elektron.
Contohnya pada pembentukan ion Na+
Na(s) → Na+ (aq) + e– - Reaksi reduksi adalah reaksi pengikatan elektron.
Contohnya pada pembentukan ion S2–
S(s) + 2 e– → S2– (aq)
Pada reaksi redoks terjadi reaksi oksidasi dan reduksi secara bersama – sama, misalnya pada pembentukan Na2S.

Pada reaksi di atas, Na mengalami reaksi oksidasi dan menyebabkan S tereduksi. Zat seperti Na ini disebut reduktor, sedangkan S disebut oksidator karena menyebabkan Na teroksidasi dan dia sendiri mengalami reaksi reduksi.
3) Reaksi Redoks Berdasarkan Perubahan Bilangan Oksidasi
Konsep reaksi redoks berikutnya adalah konsep redoks berdasarkan perubahan bilangan oksidasi. Untuk itu, penting bagi sobat idschool mengetahui cara menentukan bilangan oksidasi atom, unsur, atau senyawa terlebih dahulu. Beberapa ketentuan cara menentukan bilangan oksidasi diberikan seperti berikut.

Untuk konsep reaksi redoks berdasarkan kenaikan kenaikan bilangan oksidasi (bilok) diberikan definisi seperti berikut.
1) Reaksi oksidasi: reaksi kenaikan bilok
2) Reaksi reduksi: reaksi penurunan bilok
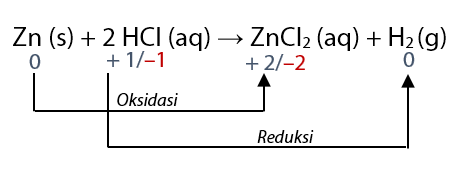
Perhatikan reaksi oksidasi dan reaksi oksidasi pada persamaan reaksi: Zn + 2 HCl → ZnCl2 + H2
Untuk menentukan mana reaksi yang mengalami oksidasi atau reduksi, sobat idschool perlu menentukan bilangan oksidasi masing – masing terlebih dahulu.
- Bilok Zn (unsur bebas) = 0
- Bilok Zn dalam ZnCl2 = +2
- Bilok H dalam HCl = +1
- Bilok H dalam H2 (unsur bebas) = 0
Baca juga: Cara Menentukan Bilangan Oksidasi
Perhatikan bahwa Zn mengalami kenaikan bilok (dari 0 menjadi + 2) maka Zn mengalami reaksi oksidasi. Sekarang perhatikan bahwa H mengalami penurunan bilok (dari + 1 menjadi 0) maka H mengalami reaksi reduksi.
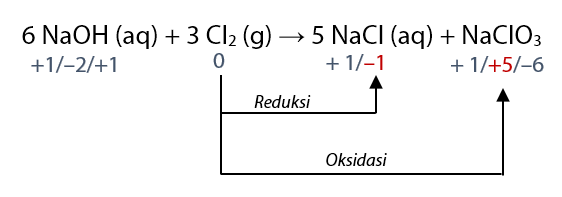
Jika suatu zat mengalami reaksi oksidasi sekaligus reduksi maka reaksi ini disebut autoredoks (disproporsionasi). Contoh persamaan dengan autoredoks terdapat pada persamaan reaksi berikut.
6 NaOH (aq) + 3 Cl2 (g) → 5 NaCl (aq) + NaClO3 (aq) + 3 H2O (l)
Menentukan bilangan oksidasi:
- Bilok Cl dalam Cl2 (unsur bebas) = 0
- Bilok Cl dalam NaCl = –1
- Bilok Cl dalam NaClO3 = +5
Perhatikan bahwa Cl mengalami mengalami kenaikan bilok (reaksi oksidasi) dan penurunan bilok (reaksi reduksi) sekaligus. Jadi, Cl mengalami autoredoks.
Demikian ulasan materi reaksi redoks (reduksi – oksidasi) yang meliputi konsep redoks berdasarkan pengikatan/pelepasan oksigen, konsep redoks pengikatan/pelepasan elektron, dan konsep redoks berdasarkan perubahan bilangan oksidasi. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Contoh Penerapan Reaksi Redoks dalam Kehidupan Sehari – Hari
