Kekuatan asam dan basa suatu larutan bergantung pada banyaknya ion-ion yang terurai dalam larutan. Besar kekuatan asam dan basa dinyatakan dalam sebuah nilai yang disebut derajat ionisasi (α). Rumus derajat ionisasi dinyatakan dalam persamaan perbandingan antara jumlah molekul zat yang terionisasi dengan jumlah molekul zat mula-mula. Rentang nilai derajat ionisasi antara 0 sampai 1, dengan 0 untuk sedikit ion yang terurai dan 1 untuk semua ion terurai.
Berdasarkan banyaknya ion-ion yang terurai, larutan asam/basa dibedekan menjadi lemah dan kuat. Setiap larutan asam/basa kuat merupakan larutan elektrolit kuat, di mana zat-zat elektrolit mengalami ionisasi sempurna (α = 1). Hampir semua molekul asam/basa kuat dalam air terurai menjadi ion-ion. Sedangkan asam/basa lemah merupakan larutan elektrolit lemah, di mana zat-zat hanya mengalami ionisasi sebagian (0<α<1). Zat-zat yang tidak mengalami ionisasi disebut dengan larutan non elektrolit (α = 0).
Bagaimana bentuk rumus derajat ionisasi? Bagaimana cara menghitung derajat ionisasi? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: Larutan Elektrolit dan Non Elektrolit
Rumus Derajat Ionisasi (α) Larutan Asam/Basa
Diketahui bawaha ada tiga jenis larutan berdasarkan kemampuan ionisasi yaitu larutan elektrolit kuat, elektrolit lemah, dan non elektrolit. Ionisasi adalah proses fisik mengubah atom/molekul menjadi ion-ion yang dapat bermuatan positif (+) atau negatif (-). Elektrolit adalah mineral bermuatan listrik yang terdapat pada suatu larutan.
Kemampuan suatu zat menghasilkan ion H+ menentukan kekuatan asam dari zat tersebut. Semakin banyak ion H+ yang mampu dihasilkan menandakan sifat asam yang semakin kuat. Begitu juga dengan kekuatan basa, kemampuan menghasilkan ion OH– menentukan kekuatan asam dari suatu zat. Semakin banyak ion OH– yang dihasilkan menandakan sifat basa yang semakin kuat.
Jumlah ion H+ dan OH– yang dihasilkan dipengaruhi oleh nilai derajat ionisasi (α). Besar dari nilai derajat ionisasi secara matematis dinyatakan melalui rumus derajat ionisasi di bawah.
Nilai α paling rendah adalah 0 dan nilai α paling tinggi adalah 1. Larutan asam/basa yang merupakan elektrolit kuat mempunyai ionisasi besar (mendekati 1). Beberapa larutan elektrolit yang merupakan asam kuat antara lain H2SO4, HCl, HNO3, HBr, HI, dan lainnya. Beberapa larutan elektrolit yang merupakan basa kuat antara lain NaOH, BaOH, KOH, Ca(OH)2, dan lainnya.
Sedangkan larutan asam basa yang merupakan elektrolit lemah memiliki derajat ionisasi kecil. Semakin kecil kemampuan larutan asam basa untuk menghasilkan ion-ion akan membuat nilai α semakin mendekati 0.
Baca Juga: Laju Reaksi dan Faktor-Faktor yang Mempengaruhinya
Tetapan Setimbang Ionisasi Asam/Basa Lemah (Ka dan Kb)
Larutan elektrolit kuat mengalami ionisasi sempurna sehingga harga α mendekati satu. Sementara itu, larutan elektrolit lemah hanya mengalami ionisasi sebagian sehingga harga α sangat kecil kurang dari 1 dan mendekati 0 (0<α<1).
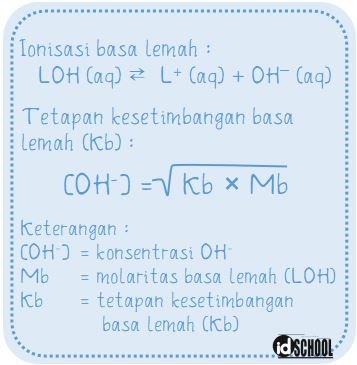
Secara umum persamaan reaksi ionisasi asam lemah memiliki persamaan HA (aq) ⇄ H+ (aq) + A– (aq). Sedangkan persamaan umum reaksi ionisasi asam basa memiliki bentuk LOH (aq) ⇄ L+ (aq) + OH– (aq). Di mana, persamaan ionisasi asam /basa lemah termasuk kesetimbangan reaksi kesetimbangan antara molekul-molekul zat elektrolit dengan ion-ionnya.
Tetapan kesetimbangan ionisasi asam lemah diberi simbol Ka. Dan tetapan kesetimbangan ionisasi basa lemah diberi simbol Kb. Rumus tetapan kesetimbangan asam/basa lemah memenuhi persamaan berikut.
Tetapan kesetimbangan asam/basa lemah memiliki hubungan dengan rumus derajat ionisasi (α). Hubungan antara α dengan Ka dan Kb dinyatakan dalam rumus berikut.
Baca Juga: Reaksi Reduksi-Oksidasi (Redoks)
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan rumus derajat ionisasi. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Penggunaan Rumus Derajat Ionisasi Elektrolit Terner
Sebanyak 3,4 gram gas NH3 (Mr = 17) dilarutkan ke dalam air sehingga volume larutan menjadi 2 liter. Jika Kb NH4OH = 10-5 maka derajat ionisasi NH4OH adalah ….
A. 0,1
B. 0,01
C. 0,90
D. 0,99
E. 1
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Massa gas NH3: Gr NH3 = 3,4 gram
- Mr NH3 = 17
- Volume larutan: V = 2 liter = 2.000 mL
- Kb NH4OH = 10-5
Menghitung konsentrasi NH3 (M NH3 = Mb):
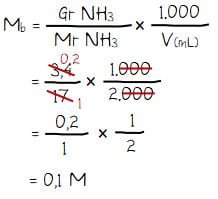
Menghitung derajat ionisasi (α) NH4OH:
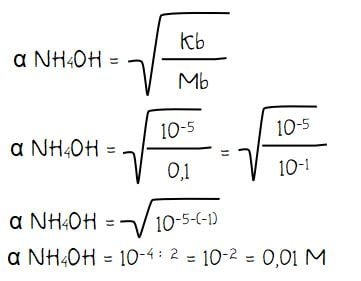
Jadi, derajat ionisasi NH4OH adalah 0,01 M.
Jawaban: B
Contoh 2 – Soal Derajat Ionisasi Elektrolit
Perhatikan tabel titik didih larutan berikut!

Derajat ionisasi elektrolit terner tersebut adalah ….
A. 0,35
B. 0,70
C. 0,85
D. 0,90
E. 0,95
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Konsentrasi larutan non elektrolit: M1 = 0,2 m
- Titik didih larutan non elektrolit: T1 = 100,10oC
- Konsentrasi larutan elektrolit terner: M2 = 0,2 m
- Titik didih larutan elektrolit terner: T2 = 100,27oC
- Jenis larutan elektrolit terner: n = 3
Menghitung tetapan Kb:
Persamaan perubahan suhu menurut sifat koligatif larutan non elektrolit adalah ΔTb = m × Kb.
100,10 – 100 = 0,2 × Kb
0,10 = 0,2Kb
Kb = 0,10/0,2 = 0,5
Menghitung nilai tetapan van hoff (i):
Persamaan perubahan suhu menurut sifat koligatif larutan elektrolit adalah ΔTb = m × Kb × i.
100,27 – 100 = 0,2 × 0,5 × I
0,27 = 0,10 × I
i = 0,27/0,10 = 2,7
Menghitung dengan rumus derajat ionisasi (α):

Jadi, derajat ionisasi elektrolit terner tersebut adalah 0,85.
Jawaban: C
Demikianlah tadi ulasan rumus derajat ionisasi yang menunjukkan kekuatan asam dan basa. Terimkasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: 3 Konsep Teori Asam Basa Menurut Arrheinus, Bronsted-Lowry, dan Lewis