Cara menghitung perubahan entalpi (ΔH) terdiri dari empat cara. Yaitu cara hitung dengan percobaan kalorimeter, Hukum Hess, berdasar data entalpi, dan energi ikatan. Empat cara menghitung perubahan entalpi tadi digunakan untuk bentuk soal yang berbeda.
Sebelumnya ingat kembali apa itu reaktan dan produk pada persamaan kimia. Reaktan adalah pereaksi, terletak di sebelah kiri tanda panah. Produk adalah hasil reaksi, terletak di sebalah kanan panah. Untuk persamaan kimia yang diikuti nilai perubahan entalpi disebut persamaan termokimia.

Lebih lanjut mengenai cara menghitung perubahan entalpi dan contoh soalnya ada di bawah.
Daftar isi:
- 1. Pengukuran ΔH dengan Kalorimetri
- 2. Hukum Hess
- 3) Berdasarkan Data Entalpi Pembentukan Standar
- 4) Data Energi Ikatan
Baca Juga: Reaksi Eksoterm dan Endoterm
1. Pengukuran ΔH dengan Kalorimetri
Kalorimeter adalah alat untuk mengukur jumlah kalor pada suatu reaksi kimia. Apa yang diukur? Yaitu suhu sebelum dan setelah reaksi. Ilmu yang memelajari pengukuran panas dan reaksi kimia atau perubahan fisik disebut Kalorimetri.
Hasil pengukuran suhu digunakan untuk menghitung kalor yang diserap atau dilepas selama reaksi. Rumus kalor larutan adalah qlarutan = m×c×ΔT. Sedangkan rumus kalor kalorimeter adalah qkalorimeter = C×ΔT.
Kalor yang diserap atau dilepaskan kalorimeter adalah kalor reaksi. Rumus kalor reaksi adalah qreaksi = –(qlarutan + qkalorimeter).
Besar perubahan entalpi dari reaksi nilainya sama dengan qreaksi.
Pada reaksi eksoterm, nilai perubahan entalpi ditandai dengan nilai negatif. Sedangkan pada reaksi endoter, nilai perubahan entalpi ditandai dengan nilai positif. Sebagian besar reaksi yang terjadi sehari-hari merupakan reaksi eksoterm.

Nilai q kalorimeter sering diabaikan. Biasanya perubahan entalpi hanya dihitung menggunakan rumus ΔH = –(m×c×ΔT).
Baca Juga: Praktikum Kimia untuk Menentukan Perubahan Entalpi dengan Kalorimeter
Cara Menghitung Perubahan Entalpi dengan Kalorimeter
Sebanyak 100 mL HCl 0,5 M dan 100 mL KOH 0,5 M yang suhu keduanya sama dengan 27oC dimasukkan ke dalam kalorimeter. Setelah reaksi ternyata suhu larutan menjadi 30,3 oC. Diketahui kalor jenis larutan 4,2 J/groC dan mmassa jenis larutan 1 gram/cm3.
Perubahan entalpi reaksi tersebut adalah ….
A. –2,77 kJ/mol
B. +2,77 kJ/mol
C. –55,4 kJ/mol
D. –67,2 kJ/mol
E. +67,2 kJ/mol
Jawab:
Dari soal diketahui beberapa nilai berikut.
V HCL 0,5 M = 100 mL = 0,1 L
V KOH 0,5 M = 100 mL = 0,1 L
Sehingga, V total = 200 mL = 0,2 L
Suhu awal = 27oC
Suhu akhir = 30,3 oC
Perubahan suhu: ΔT = 30,3 oC – 27 oC = 3,3 oC
Kalor jenis larutan: c = 4,2 J/groC
Massa jenis larutan: ρ = 1 gram/cm3 = 1 gram/mL
Menghitung massa larutan:
massa HCI = massa KOH = ρ × V
Sehingga,
mHCl = mKOH
= 1 gram/mL × 100 mL = 100 gram
Menentukan mol HCl dan KOH:
molHCl = M × V
= 0,5 × 0,1 L
= 0,05 mol
molKOH = M × V
= 0,5 × 0,1 L
= 0,05 mol
Menentukan mol larutan:

Menghitung perubahan entalpi reaksi:
Jadi, perubahan entalpi reaksi tersebut adalah –55,4 kJ/mol.
2. Hukum Hess
Seorang ahli kimia Germain Hess mengenalkan sebuah hukum. Yang saat ini dikenal dengan Hukum Hess. Bunyi Hukum Hess menyatakan bahwa perubahan entalpi tidak bergantung pada jalannya reaksi tetapi bergantung pada keadaan awal dan akhir reaksi.
Misalnya, suatu reaksi yang mengubah pereaksi A menjadi produk C. Dapat terjadi secara langsung dengan perubahan entalpi ΔH1.
Selain itu, reaksi A→C dapat juga berlangsung dalam 2 tahap misalkan A→B kemudian B→C. Diketahui perubahan entalpi untuk reaksi A→B adalah ΔH2 dan perubahan entalpi untuk reaksi B→C adalah ΔH3.
Hukum Hess menyatakan persamaan ΔH1 = ΔH2 + ΔH3.
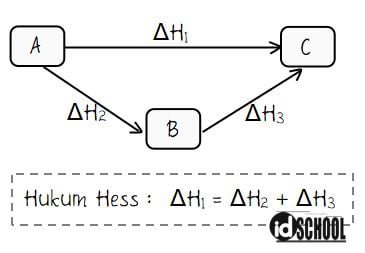
Cara Menghitung Perubahan Entalpi dengan Hukum Hess
Perhatikan diagram tingkat energi berikut!

Nilai x pada diagram siklus di atas sebesar …. kJ
Jawab:
Berdasarkan Hukum Hess dapat diperoleh persamaan ΔH1 = ΔH2 + ΔH3.
Sehingga,
ΔH1 = ΔH2 + ΔH3
–290 = 593 + x
x = –290 – 593 = –883 kJ
Jadi, perubahan entalpi (ΔH) pada diagram siklus tersebut adalah sebesar –883 kJ.
Baca Juga: Diagram Tingkat Energi Sesuai Hukum Hess
3) Berdasarkan Data Entalpi Pembentukan Standar
Besarnya perubahan entalpi reaksi dapat ditentukan dengan data entalpi pembentukan standar. Di mana perubahan entalpi reaksi sama dengan total perubahan entalpi produk dikurangi perubahan entalpi reaktan.
Misalkan pada persamaan reaksi yang sudah setara: aA + bB → cC + dD. Di mana a, b, c, dan d adalah koefisien-koefisien reaksi. Sementara A, B, C, dan D adalah zat-zat dalam persamaan reaksi tersebut.
Kemudian diketahui juga perubahan entalpi pembentukan (ΔHfo) standar untuk setiap senyawa.
Persamaan untuk menghitung perubahan entalpi (ΔH) pada reaksi tersebut dengan informasi ΔHfo dilakukan seperti cara di bawah.
ΔH = ƩΔHproduk – ƩΔHreaktan
ΔH = (c × ΔHf° C + d × ΔHf° D) – (a × ΔHf° A + b × ΔHf° B)
Cara Menghitung Perubahan Entalpi Melalui Data Entalpi Pembentukan Standar
Diketahui data entalpi pembentukan standar: ΔHfo CO2 (g) = –394 kJ/mol, ΔHfo H2O (g) = –286 kJ/mol, dan ΔHfo C6H6 (g) = 83 kJ/mol. Harga ΔH pembakaran standar benzena adalah … kJ/mol.
Jawab:
Persamaan reaksi pada pembakaran gas benzena (belum setara): C₆H₆ (g) + O₂ (g) → CO₂ (g) + H₂O (g). Penyetaraan reaksi pembakaran gas benzena menghasilkan: 2C₆H₆ (g) + 9O₂ (g) → 6CO₂ (g) + 6H₂O (g).
Menghitung perubahan entalpi:

Jadi, perubahan entalpi (ΔH) pada pembakaran 1 mol C₆H₆ adalah –2.123 kJ/mol.
Baca Juga: Energi Kinetik Gas Ideal
4) Data Energi Ikatan
Energi ikatan adalah energi rata-rata untuk memutuskan satu ikatan dalam 1 mol molekul menjadi atom penyusunnya.
Perubahan entalpi (∆H) merupakan perubahan energi panas (kalor) yang diukur dalam keadaan standar (tekanan dan suhu tetap). Penentuan perubahan entalpi suatu reaksi dapat dihitung dengan menggunakan berbagai cara, salah satunya adalah menggunakan data energi ikatan dari masing-masing senyawa pembentuk reaksi.
Rumus:

Cara Menghitung Perubahan Entalpi dari Energi Ikatan Rata-Rata
Diketahui nilai energi ikatan rata-rata sebagai berikut.
| Ikatan | Energi Rata-Rata (kJ/mol) |
| C – H | +410 |
| C – F | +485 |
| F – F | +195 |
| H – F | +565 |
Nilai entalpi dari reaksi CHF3 (g) + F2 (g) → CF4 (g) + HF (g) adalah …
A. +481 kJ/mol
B. -481 kJ/mol
C. +962 kJ/mol
D. -962 kJ/mol
E. +1.202 kJ/mol
Jawab:
Gambar struktur ikatan untuk reaksi CHF3 (g) + F2 (g) → CF4 (g) + HF (g):
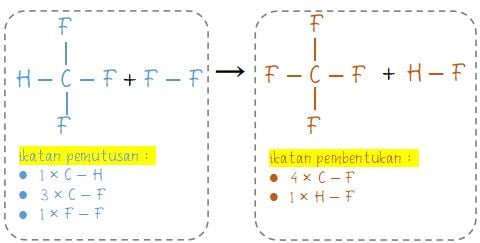
Jumlah energi rata-rata pemutusan ikatan (reaktan/pereaksi):
1 × C–H = 1 × (+410) = +410
3 × C–F = 3 × (+485) = +1.455
1 × F–F = 1 × (+159) = 159
∑energi pemutusan = 2.024 kJ/mol
Jumlah energi rata-rata pembentukan ikatan (produk/hasil reaksi):
4 × C–F = 4 × (+485) = +1.940
1 × H–F = 1 × (+565) = +565
∑energi pembentukan = 2.505 kJ/mol
Menghitung besarnya perubahan entalpi (ΔH) reaksi:
ΔH = Σenergi pemutusan – Σenergi pembentukan
ΔH = 2.024 – 2.505 = –481 kJ/mol
Jadi, nilai entalpi dari reaksi CHF3 (g) + F2 (g) → CF4 (g) + HF (g) adalah –481 kJ/mol (B). Tanda negatif menunjukkan bahwa jenis reaksi yang terjadi adalah reaksi ekosterm.
Demikianlah tadi ulasan empat cara menghitung perubahan entalpi yang digunakan untuk berbagai bentuk soal atau permasalahan. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Cara Menentukan Biloks (Bilangan Oksidasi)
