Rumus kadar zat atau kadar unsur dalam senyata menyatakan banyaknya komponen zat/unsur dalam suatu senyawa. Bentuk umum rumus kadar zat atau unsur yang terkandung dalam suatu senyawa merupakan perbandingan biasa. Untuk bahasan kimia mengenai kadar unsur melibatkan hukum perbandingan massa (Hukum Proust).
Contoh sederhana kadar zat terdapat pada botol minuman yang menyertakan keterangan 5% alkohol. Artinya, larutan yang terdapat pada botol tersebut mengandung sejumlah alkohol. Banyaknya alkohol dalam botol minuman adalah 5% dari keseluruhan larutan. Jika larutan dalam botol tersebut adalah 100 ml maka banyak alkohol dalam botol tersebut sama dengan 5 ml.

Baca Juga: Cara Menentukan Rumus Kimia dari Suatu Senyawa
Apa rumus kadar zat atau unsur dalam senyawa? Bagaimana cara menentukan kadar zat atau unsur yang terkandung dalam sebuah senyawa? Sobat idschol dapat mencari tahu jawabannya melalui ulasan di bawah.
Persamaan Rumus Kadar Zat dalam Senyawa
Kadar zat dalam campuran, larutan, atau senyawa menunjukkan banyaknya komponen suatu zat dalam senyawa atau campurannya. Satuan yang digunakan untuk mementukan kadar zat dapat menggunakan persen massa, volume, atau bagian per sejuta (bpj)/part per million (ppm).
Persen massa menyetakan masaa suatu zat yang terdapat dalam setiap 100 gram campuran. Begitu juga dengan persen volume yang menyatakan volume zat yang terdapat dalam setiap 100 bagian volume campuran.
Sedangkan bagian per sejuta (bpj) atau part per million (ppm) adalah satuan yang digunakan untuk menyatakan kadar suatu zat yang kuantitasnya sangat sedikit. Kadar zat dalam ppm menyatakan banyaknya bagian massa zat suatu zat dalam sejuta bagian per massa campuran.
Kumpulan rumus kadar zat untuk persen massa, volume, dan bagian per sejuta (bpj)/part per million terdapat pada persamaan-persamaan berikut.

Perhatikan contoh penggunaan rumus kadar zat untuk menyelesaiakan soal sederhana di bawah.
Soal:
Tentukan massa natrium hidroksida (NaOH) dalam 0,5 liter larutan NaOH 20% (massa jenis larutan (ρ) = 1 gram/mℓ)!
Penyelesaian:
Dari informasi yang diberikan diperoleh beberapa nilai besaran berikut.
- Volume larutan: v = 0,5 ℓ = 500 mℓ
- Kadar NaOH dalam larutan: %NaOH = 20%
- Massa jenis larutan: ρ = 1 gram/mℓ!
Menghitung massa larutan:
ρ = massa/volume
massa = ρ × volume
massa larutan = 1 gram/mℓ × 500 mℓ = 500 gram
Menghitung massa NaOH:
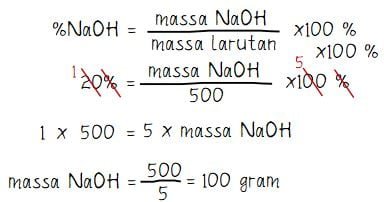
Jadi, massa natrium hidroksida (NaOH) dalam 0,5 liter larutan NaOH 20% adalah 100 gram.
Baca Juga: Jenis-Jenis Ikatan Kimia (Ion, Kovalen, dan Logam)
Rumus Kadar Unsur dalam Senyawa
Unsur adalah bentuk materi paling sederhana yang tidak dapat diuraikan lagi menjadi materi yang lebih sederhana dengan reaksi kimia. Contoh unsur adalah karbon (C), hidrogen (H), besi atau ferum (Fe), oksigen (O), kalsium (Ca) dan lain sebagainya.
Sementara senyawa adalah zat yang dapat diuraikan menjadi dua zat atau lebih melalui reaksi kimia. Contoh senyawa adalah air (H2O), garam dapur (NaCl), glukosa (C6H12O6), asam cuka (CH3COOH), dan lain sebagainya.
Kadar unsur dalam senyawa merupakan persentase massa suatu unsur dalam senyawa. Banyaknya kadar unsur di dalam senyawa dapat dicari melalui perbandingan jumlah massa atom relatif dari unsue per jumlah massa atom relatif dari senyawa.
Secara matematis, persamaan rumus kadar unsur dalam suatu senyawa dinyatakan melalui persamaan berikut.
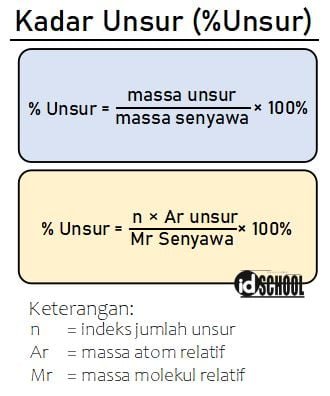
Sebagai contoh, perhatikan cara mendapatkan kadar unsur dalam senyawa berikut.
Soal:
Tentukan kadar unsur karbon, hidrogen, dan oksigen dalam senyawa glukoksa (C2H12O6) dalam bentuk persen! (Ar C = 12, H = 1, dan O = 16)
Penyelesaian:
Perhatikan rumus senyawa glukosa yaitu C6H12O6 yang di dalamnya memuat 6 unsur karbon (C), 12 unsur hidrogen (H), dan 6 unsur oksigen (O). Massa molekul relatif glukosa adalah sebagai berikut.
Mr glukosa = 6 × Ar C + 12 × Ar H + 6× Ar O
= 6 × 12 + 12 × 1 + 6× 16
= 72 + 12 + 96 = 180
Persentase kadar masing-masing unsur untuk karbon (C), hidrogen (H), dan oksigen (O) dapat dicari seperti perhitungan berikut.
Kadar karbon (C) dalam glukosa:

Kadar hidrogen (H) dalam glukosa:
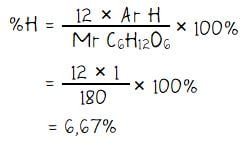
Persentase kadar unsur oksigen (O) dalam glukosa:
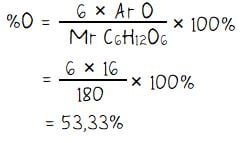
Jadi, persentase kadar unsur karbon, hidrogen, dan oksigen dalam senyawa glukoksa berturut adalah 40%, 6,67%, dan 53,33%.
Baca Juga: Rumus Empiris dan Rumus Molekul
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Penggunaan Rumus Kadar Zat dalam Senyawa
Pembakaran sempurna 32 gram cuplikan belerang menghasilkan 48 gram belerang trioksida. Kadar belerang dalam cuplikan tersebut adalah …. (Ar S = 32, O = 16)
A. 30%
B. 45%
C. 60%
D. 75%
E. 100%
Pembahasan:
Rumus senyawa dari belerang trioksida atau sulfur trioksida adalah SO3. Keterangan yang diberikan pada soal memberikan informasi-informasi seperti berikut.
- Massa belerang (S): massaS = 32 gram
- Massa SO3 yang dihasilkan: massaSO3 = 48 gram
- Ar S = 32; Ar O =16
Persamaan reaksi pada pembakaran (membutuhkan oksigen) belerang yang menghasilkan belerang trioksida: 2S + 3O2 → 2SO3
Jumlah mol dalam SO3:
nSO3 = massa/Mr
= 48/32+3(16)
= 48/32+48 = 48/80 = 3/5
Pada persamaan reaksi 2S + 3O2 → 2SO3, koefisien belerang (S) sama dengan koefisien belerang trioksida (SO3). Sehingga, jumlah mol S dan SO3 adalah sama yaitu 3/5.
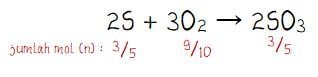
Massa belerang dalam cuplikan:
massaS = n × Ar S
= 3/5 × 32
= 3/5 × 32 = 19,2 gram
Kadar belerang dalam cuplikan:

Jadi, kadar belerang dalam cuplikan tersebut adalah 60%
Jawaban: C
Contoh 2 – Penggunaan Rumus Kadar Zat dalam Senyawa
Cuplikan bubuk besi sebanyak 5 gram dipanaskan dengan gas klorin menghasilkan 10 gram besi (II) klorida, FeCl2, (Ar Fe=56, Cl=35,5). Kadar unsur besi dalam culikan tersebut adalah ….
A. 4,41%
B. 14,20%
C. 71,00%
D. 88,20%
E. 100,00%
Pembahasan:
Menghitung massa molekul relatif besi (II) klorida:
Mr FeCl2 = Ar Fe + (2 × Ar Cl)
= 56 + 2×35,5
= 127
Massa Fe = Ar Fe/Mr FeCl2 × massa FeCl2
= 56/127 × 10 gram
= 4,41 gram
Persen massa Fe dalam FeCl2: %Fe = 4,41/5 × 100% = 88,2%
Jadi, kadar unsur besi dalam culikan tersebut adalah 88,20%
Jawaban: D
Contoh 3 – Penggunaan Rumus Soal Kadar Zat dalam Senyawa
Jika diketahui massa atom relatif Fe = 56, S = 32, O = 16 maka massa besi yang terdapat dalam 4 gram Fe2(SO4)3 adalah ….
A. 0,56 gram
B. 0,96 gram
C. 1,12 gram
D. 1,68 gram
E. 1,92 gram
Pembahasan:
Menghitung massa molekul relaitf Fe2(SO4)3:
Mr Fe2(SO4)3 = 2 × Mr Fe + 3 × Mr S + 12 × Mr O
= 2 × 56 + 3 × 32 + 12 × 16
= 112 + 96 + 192 = 400
Massa besi dalam 4 gram Fe2(SO4)3:
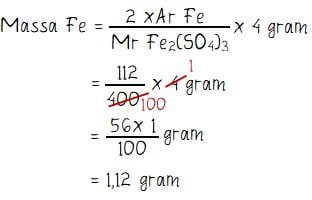
Jadi, massa besi yang terdapat dalam 4 gram Fe2(SO4)3 adalah 1,12 gram.
Jawaban: C
Contoh 4 – Penggunaan Rumus Kadar Zat dalam Senyawa
Untuk oksidasi sempurna 1 liter campuran yang terdiri atas 60% metana (CH4) dan 40% etana (C2H6), dibutuhkan O2 murni sebanyak ….
A. 2,4 liter
B. 2,6 liter
C. 2,8 liter
D. 3,0 liter
E. 3,2 liter
Pembahasan:
Menghitung volume CH4 dan C2H6:
- CH4 = 60% × 1 liter = 0,6 L
- C2H6 = 40% × 1 liter = 0,4 L
Persamaan reaksi:
- CH4 + 2 O2 → CO2 + 2 H2O
- 2 C2H6 + 7 O2 → 4 CO2 + 6 H2O
Perbandingan volume pada suatu persamaan reaksi kimia dapat diperoleh dari perbandingan koefisien seperti cara berikut.
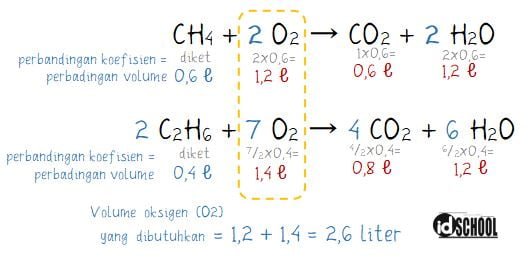
Jadi, volume O2 murni yang dibutuhkan adalah sebanyak 2,6 liter.
Jawaban: B
Demikianlah tadi ulasan rumus kadar zat dan/atau rumus kadar unsur dalam senyawa/larutan yang meliputi persen massa, volume, dan part per million (ppm). Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Cara Menentukan Biloks (Bilangan Oksidasi)
