Salah satu cara untuk menghitung perubahan entalpi (ΔH) dapat melalui kalorimeter degan rumus q reaksi. Simbol q digunakan untuk menyatakan besar kalor dengan satuan Joule (J). Di mana persamaan rumus q reaksi bergantung dengan nilai kalor larutan (qlarutan = m×c×ΔT) dan q kalorimeter (qkalorimeter = C×ΔT).
Kemampuan suatu zat untuk menyerap atau melepas kalor berbeda-beda bergantung dari kalor jenis (c) dan kapasitas kalor (C).
Kalor jenis (c) adalah jumlah kalor yang dibutuhkan untuk menaikkan suhu 1 gram zat sebesar 1 oC. Sedangkan kapasitas kalor (C) adalah jumlah kalor yang dibutuhkan untuk menaikkan zat setiap 1 oC.
Bagaimana bentuk persamaan rumus q reaksi? Apa hubungannya rumus q reaksi dengan perubahan entalpi pada percobaan menggunakan kalorimeter? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: Reaksi Eksoterm dan Endoterm
Rumus q Reaksi
Kalorimeter adalah sebuah alat yang digunakan untuk mengukur jumlah kalor yang diserap atau dilepas selama reaksi. Hasil pengukuran kalor ini nantinya digunakan untuk menentukan besar perubahan entalpi (ΔH) reaksi.
Dari suatu percobaan diperoleh kesimpulan bahwa kalor yang dihasilkan oleh reaksi atau sistem sama dengan kalor yang diterima oleh air dan kalorimeter. Pengukuran dengan kalorimeter menggunakan asumsi bahwa pada reaksi tidak ada kalor yang keluar ke lingkungan (proses adiabatik). Persamaan yang diperoleh adalah qreaksi + qlarutan + qkalorimeter = 0 atau qreaksi = –(qlarutan + qkalorimeter).
Besar kalor yang diserap atau dilepas suatu zat dapat dihitung melalui rumus q larutan = m×c×ΔT. Besar kalor yang diserap atau dilepas untuk menaikkan suhu zat sebesar 1oC pada kalorimeter adalah q kalorimeter = C×ΔT. Sehingga, rumus q reaksi sama dengan –(m×c×ΔT + C×ΔT).
Besar kalor (q) pada reaksi dengan volume tetap akan sama dengan perubahan energo. Sehingga ΔH = ΔE ~ q. Pada pengukuran kalor reaksi pada kalorimeter dilakukan dengan tekanan tetap sehingga q = qreaksi. Sehingga besar perubahan entalpi (H) dapat diperoleh melalaui persamana ΔH = qreaksi.
Ringkasnya, hubungan antara rumus q reaksi dan perubahan entalpi diberikan seperti persamaan-persamaan berikut.

Keterangan negatif pada rumus ΔH menunjukkan bahwa reaksi yang terjadi merupakan rekasi eksoterm (mengalmi kenaikan suhu). Nyatanya, lebih banyak reaksi kimia dalam kehidupan sehari-hari merupakan reaksi eksoterm, sedangkan sedikit reaksi merupakan reaksi endoterm.
Jika reaksi yang terjadi adalah reaksi endoterm (mengalami penurunan suhu) maka rumus ΔH disertai dengan tanda positif.
Baca Juga: Macam-Macam Perubahan Entalpi (ΔH) Standar
Cara Menghitung Perubahan Entalpi dengan Kalorimeter
Langkah untuk menghitung perubahan entalpi dengan kalorimeter meliputi hitungan perubahan suhu kalor reaksi dengan rumus q reaksi, dan ΔH. Bagaimana cara penggunaan rumus q reaksi dan perubahan entalpi (ΔH) dapat dilihat seperti pada cara penyelesaian soal berikut.
Soal:
Pada pelarutan 2 gram kristal NaOH (Mr = 40) dalam 50 mL air terjadi kenaikan suhu dari 27oC menjadi 32oC. Jika kalor jenis larutan adalah 4,2 J/groC dan massa jenis air sama dengan 1 gram/mL maka berapakah besar perubahan entalpi pelarutan NaOH?
Penyelesaian:
Dari soal diperoleh beberapa informasi seperti berikut
- Massa NaOH: m = 2 gram; Mr NaOH = 40
- Volume air: Vair = 50 mL = 50 mL × 1 gram/mL = 50 gram
- Kenaikan suhu (reaksi eksoterm): ΔT = 32oC– 27oC = 5oC
- Kalor jenis larutan: c = 4,2 J/groC
Jawab:

Baca Juga: Perubahan Entalpi pada Diagram Tingkat Energi (Hukum Hess)
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idshcool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Penggunaan Rumus q Reaksi untuk Menghitung Perubahan Entalpi
Dalam kalorimeter direaksikan suatu zat dan ternyata 2.500 gram air yang mengelilingi terjadi kenaikkan suhu dari 25 °C menjadi 29 °C. Bila kalor jenis air = 4.180 joule/kg°C, maka besarnya kalor yang dibebaskan sebesar ….
A. 4,18 kJ
B. 41,8 kJ
C. 418 kJ
D. 4.180 kJ
E. 41.800
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Massa zat: m = 2.500 gram = 2,5 kg
- Suhu awal: T1 = 25oC
- Suhu akhir: T2 = 29oC
- Perubahan suhu: ΔT= T2 – T1
ΔT= 29 – 25
ΔT= 4oC - Kalor jenis air: cair = 4.180 joule/kg°C
Menghitung kalor yang dibebaskan ke lingkungan:
q = –(m × c × ΔT)
= –(2,5 × 4,180 × 4)
= –41,8 kJ
Tanda negatif menunjukkan bawha reaksi yang terjadi adalah reaksi eksoterm di mana kalor dibebaskan ke lingkungan. Jadi, besarnya kalor yang dibebaskan sebesar 41,8 kJ.
Jawaban: B
Contoh 2 – Soal Penggunaan Rumus q Reaksi untuk Menghitung Perubahan Entalpi
Sebanyak 250 mL larutan KOH 0,4 M dicampur dengan 250 mL larutan HCl 0,4 M. Hasil pencampuran mengakibatkan suhu naik dari 27oC menjadi 35oC. Jika diketahui berat jenis larutan adalah 4,2 joule/g maka besar perubahan entalpi pada reaksi netralisasi tersebut adalah …. (massa jenis larutan ρ = 1 gram/mL)
A. –168 kJ
B. –16,8 kJ
C. +16,8 kJ
D. +168 kJ
E. +1.680 kJ
Pembahasan:
Berdasarkan informasi yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Volume KOH 0,4 M: V1 = 250 mL
- Volume HCL 0,4 M: V2 = 250 mL
- Perubahan suhu: ΔH = 35oC – 27oC = 8oC
- Berat jenis larutan: clarutan = 4,2 Joule/gram
Volume larutan KOH dan HCl sama dengan V1 + V2 = 250 mL + 250 mL = 500 mL. Besar volume yang digunakan dalam perhitungan adalah massa (m) yang memiliki satuan gram. Sehingga besar volume perlu diubah terlebih dahulu ke massa seperti cara berikut.

Menentukan mol larutan yang terbentuk dari reaksi KOH dan HCl:


Menghitung perubahan entalpi pada reaksi KOH dan HCl:
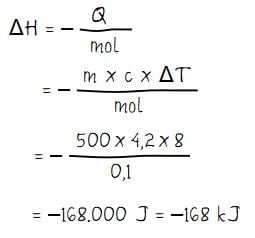
Jadi, besar perubahan entalpi ΔH pada reaksi netralisasi tersebut adalah –168 kJ.
Jawaban: A
Contoh 3 – Penggunaan Rumus q Reaksi dan Perubahan Entalpi
Sebanyak 32 gram gas metana dibakar dalam kalorimeter. Setelah reaksi terjadi kenaikan suhu dari 24,8oC menjadi 88,5oC. Jika kalorimeter berisi 6 liter air, kalor jenis air 4,2 J/goC, dan kapasitas kalorimeter sebesar 2.470 J/oC maka kalor reaksi pembakaran gas metana setiap 1 mol sebesar …. (Ar C = 12, H = 1)
A. –890 kJ/mol
B. –768 kJ/mol
C. –593 kJ/mol
D. +768 kJ/mol
E. –890 kJ/mol
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Massa gas metana: m = 32 gram
- Perubahan suhu: ΔT = 88,5oC– 24,8oC = 63,7oC
- Volume air: Vair = 6 liter
- Kalor jenis air: c = 4,2 J/goC
- Kapasitas kalorimeter: C = 2.470 J/oC
Menghitung qreaksi:
qreaksi = –( m×c×ΔT + C×ΔT)
= –( 6.000×4,2×63,7 + 2.740×63,7)
= –1.780 kJ
Jumlah mol 32 gram gas metana (CH4) yang dibakar dalam kalorimeter:

Jadi, kalor reaksi pembakaran gas metana setiap 1 mol sebesar –890 kJ/mol.
Jawaban: A
Demikianlah tadi ulasan rumus q reaksi pada cara menghitung perubahan entalpi dengan kalorimeter. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
