Perubahan entalpi yang terjadi dalam suatu reaksi dapat digambarkan dalam sebuah diagram perubahan entalpi reaksi (diagram tingkat energi). Hukum Hess menerangkan bagaimana hubungan perubahan entalpi (ΔH) pada reaksi yang dapat terjadi dalam dua tahap atau lebih.
Hukum Hess menerangkan bahwa fungsi keadaan hanya bergantung pada keadaan awal dan akhir dari pereaksi (reaktan) dan hasil reaksi (produk). Sedangkan jalannya perubahan zat pereaksi menjadi hasil reaksi yang dapat digambarkan dalam diagram perubahan entalpi reaksi tidak memengaruhi besar perubahan entalpi.
Misalnya pada suatu reaksi yang mengubah pereaksi A menjadi produk C dengan perubahan entalpi ΔH1. Di mana reaksi A → C dapat berlangsung dalam 2 tahap yaitu A → B dan B → C. Perubahan entalpi untuk reaksi A→B adalah ΔH2 dan perubahan entalpi untuk reaksi B→C adalah ΔH3.
Menurut percobaan yang dilakukan Germain Hess diperoleh hubungan ΔH1 = ΔH2 + ΔH3 yang sesuai dengan bentuk diagram perubahan entalpi reaksi berikut.

Baca Juga: Hukum Gay Lussac (Hukum Perbandingan Volume)
Bagaimana bunyi Hukum Hess? Bagaimana penerapan Hukum Hess untuk menghitung ΔH dari diagram perubahan entalpi reaksi? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Bunyi Hukum Hess
Germain Henry Hess adalah seorang ahli kimia Jerman. Melalui sebuah percobaan, Hess menyimpulkan sebuah pernyataan yang disebut Hukum Hess. Percobaan yang dilakukan Hess melalui manipulasi persamaan termokimia untuk menghitung perubahan entalpi (ΔH).
Hukum Hess:
Perubahan entalpi standar suatu reaksi kimia hanya ditentukan oleh keadaan awal dan akhir reaksi, tidak tergantung dari jalan untuk mencapai keadaan akhir.
Dengan Hukum Hess, perubahan entalpi suatu reaksi mungkin untuk dihitung dari perubahan entalpi reaksi lain yang nilainya sudah diketahui. Dalam penerapannya, ada beberapa prinsip yang peru diperhatikan untuk menentukan nilai perubahan entalpi. Beberapa prinsip perhitungan persamaan termokimia menurut Hukum Hess meliputi poin-poin berikut.
- Jika suatu persamaan reaksi harus dibalik maka tanda ΔH juga dibalik.
Contoh:
Reaksi: H2 (g) + O2 (g) → H2O (l) ΔH = –187,8 kJ
Reaksi yang dibalik: H2O (l) → H2 (g) + O2 (g) ΔH = +187,8 kJ
- Jika pada penjumlahan reaksi terdapat zat yang muncul pada kedua persamaan dengan fase zat yang sama maka zat tersebut dapat dihilangkan.
Contoh:

- Jika ada perkalian koefisien pada suatu reaksi maka nilai perubahan AH juga dikalikan dengan bilangan yang sama.
Contoh:
Rekasi: KCl (s) + H2O (l) → HCl (g) + KOH (s) ΔH = +203,6 kJ
Reaksi dengan perkalian koefisien: 2KCl (s) + 2H2O (l) → 2HCl (g) + 2KOH (s) ΔH = +407,2 kJ
Baca Juga: Persamaan Laju Reaksi dan Cara Menentukan Nilai Orde Reaksi
Contoh Penggunaan Hukum Hess
Diketahui perubahan entalpi untuk dua persamaan termokimia berikut.
(1) C (s) + O2 (g) → CO2 (g) ΔH = –393,5 kJ
(2) CO (g) + 1/2O2 (g) → CO2 (g) ΔH = –283,0 kJ
Soal:
Tentukan perubahan entalpi untuk reaksi C (s) + 1/2Os (g) → CO (g)!
Penyelesaian:
Soal perubahan entalpi seperti di atas dapat diselesaikan melalui dua langkah berikut.
Langkah 1: susun persamaan reaksi sehingga akan menghasilkan persamaan zat-zat pereaksi di sebelah kiri dan zat-zat produk di sebelah kanan.
Pada reaksi yang akan ditentukan gas CO berada di ruas kanan sedangkan pada reaksi (2) persamaan reaksi diketahui untuk gas CO berada di ruas kiri. Sehingga, susunan reaksi 2 perlu dibalik begitu juga tanda ΔH juga perlu dibalik.
(1) C (s) + O2 (g) → CO2 (g) ΔH = –393,5 kJ
(3) CO2 (g) → CO (g) + 1/2O2 (g) ΔH = +283,0 kJ
Langkah 2: menggabungkan reaksi dan menjumlahkan perubahan entalpi.
Penjumlahan persamaan reaksi (1) dan (3) kemudian dapat diperoleh reaksi C (s) + 1/2Os (g) → CO (g) dengan ΔH = –110,5 kJ.

Baca Juga: Rumus Kadar Zat/Unsur dalam Suatu Senyawa/Larutan
Diagram Perubahan Entalpi Reaksi
Diagram perubahan entalpi reaksi atau yang sering juga disebut dengan diagram tingkat energi menunjukkan perubahan entalpi pada suatu reaksi kimia.
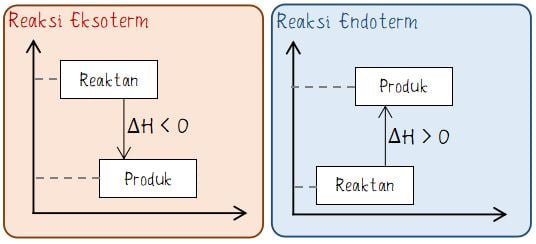
Pada diagram perubahan entalpi reaksi umumnya terdapat keterangan pereaksi, produk, dan bersar perubahan entalpi. Antara pereaksi dan produk dihubungkan oleh sebuah anak panah dan disertai keterangan nilai perubahan entalpi.
Letak pereaksi pada diagram tingkat energi berada di pangkah anak panah. Sedangkan hasil reaksi (produk) berada di ujung arah anak panah. Arah anak panah pada reaksi eksoterm menuju ke bawah (ΔH < 0), sedangkan pada arah anak panah pada reaksi endoterm menuju ke atas (ΔH < 0).
Dalam diagram tingkat energi dapat memuat persamaan reaksi untuk dua tahap atau lebih. Misalnya pada pembakaran metana (CH4) untuk menghasilkan gas H2O dan kemudian pengembunan gas H2O untuk keadaan cair.
Perubahan entalpi untuk reaksi CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (l) adalah ΔH1 = –980 kJ. Tahapan reaksi dapat terjadi dengan CH4 (g) + 2O2 (g) → CO2 (g) + 2H2O (g) dengan ΔH2 = –802 kJ, kemudian reaksi CO2 (g) + 2H2O (g) – CO2 (g) + 2H2O (l) dengan ΔH3 = –88 kJ.
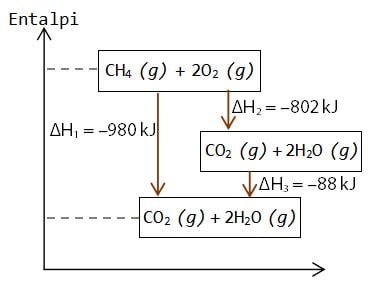
Perhatikan nilai perubahan entalpi pada diagram tingkat energi yang diberikan di atas. Bahwa nilai ΔH1 = ΔH2 + ΔH3 di mana kondisi ini sesuai dengan pernyataan dalam Hukum Hess.
Baca Juga: Senyawa Hidrokarbon (Alkana, Alkena, dan Alkuna)
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idshcool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Diagram Perubahan Entalpi Reaksi Hukum Hess
Perhatikan diagram entalpi reaksi berikut!

Besarnya perubahan entalpi (ΔH1) adalah ….
A. +789,6 kJ
B. +347,6 kJ
C. +173,8 kJ
D. –394,8 kJ
E. –789,6 kJ
Pembahasan:
Dari diagram perubahan entalpi reaksi yang diberikan dapat diperoleh beberapa informasi seperti beikut.
1) C (s) + 2O2 (g) → 2 CO2 (g) ΔH1
2) 2 C (s) + 2O2 (g) → 2 CO (g) + O2 (g) ΔH2 = –221 kJ
3) CO (g) + O2 (g) → 2 CO2 (g) ΔH3 = –568,6 kJ
Berdasarkan Hukum Hess di mana perubahan entalpi suatu rekasi hanya bergantung keadaan awal dan akhir. Atau dapat disimpulkan bahwa . Sehingga, persamaan perubahan entalpi yang sesuai dengan grafik energi yang diberikan adalah ΔH1 = ΔH2 + ΔH3.
ΔH1 = ΔH2 + ΔH3
ΔH1 = –221 kJ + (–568,6 kJ)
= –221 kJ – 568,6 kJ = –789 kJ
Jadi, besarnya perubahan entalpi (ΔH1) adalah –789,6 kJ.
Jawaban: E
Contoh 2 – Soal Diagram Perubahan Entalpi Reaksi Hukum Hess
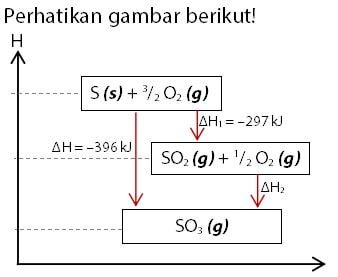
Sebuah pabrik membutuhkan SO3 untuk membuat asam sulfat. Pada rentang waktu tertentu, pabrik membakar batubara yang menghasilkan 12,8 gram SO2. Kalor yang dihasilkan dari oksidasi SO2 menjadi SO3 pada rentang waktu tersebut sebesar …. (Ar S = 32; O = 16)
A. 99 kJ
B. 49,5 kJ
C. 26,4 kJ
D. 24,75 kJ
E. 19,8 kJ
Pembahasan:
Perubahan entalpi pada reaksi yang berjalan 2 tahap atau lebih sama dengan jumlah perubahan entalpi dari setiap tahapannya (Hukum Hess). Sehingga, dari diagram perubahan entalpi reaksi yang diberikan dapat diperoleh persamaan yaitu ΔH = ΔH1 + ΔH2.
ΔH = ΔH1 + ΔH2
ΔH2 = ΔH – ΔH1
ΔH2 = –396 kJ + (–297 kJ)
ΔH2 = –396 kJ – 297 kJ
ΔH2 = –99 kJ
Diperoleh perubahan entalpi ΔH2 = –99 kJ, tanda negatif di depan bilangan menunjukkan bahwa reaksi yang terjadi melepaskan kalor. Sehingga dapat disimpulkan bahwa kalor yang dilepaskan pada reaksi SO2 (g) + 1/2 O2 (g) → SO3 (g) adalah 99 kJ untuk 1 mol SO2.
Untuk menghitung kalor yang dilepaskan pada pembakaran batubara yang menghasilkan 12,8 gram SO2 perlu dihitung mol SO2 terlebih dahulu. Perhitungan untuk mendapatkan mol SO2 diberikan seperti cara berikut.

Diperoleh jumlah mol untuk 12,8 gram SO2 adalah 0,2 mol. Diketahui bahwa perubahan entalpi yang dilepaskan untuk 1 mol SO2 adalah 99 kJ. Sehingga, perubahan entalpi atau kalor yang dilepaskan untuk 12,8 gram SO2 dapat diperoleh seperti perhitungan di bawah.
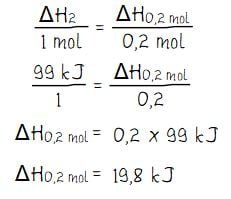
Jadi, kalor yang dihasilkan dari oksidasi SO2 menjadi SO3 pada rentang waktu tersebut sebesar 19,8 kJ.
Jawaban: E
Demikianlah tadi ulasan Hukum Hess pada cara menghitung ΔH dari diagram perubahan entalpi reaksi. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Reaksi Redoks (Reaksi Reduksi dan Oksidasi)
