Laju reaksi untuk setiap zat yang terlibat reaksi dapat diketahui melalui rumus laju reaksi. Sedangkan laju reaksi keseluruhan pada waktu t dinyatakan dalam sebuah persamaan laju reaksi. Di mana persamaan tersebut merupakan fungsi dari konsentrasi zat-zat pereaksinya. Pada persamaan laju reaksi juga memuat tetapan laju reaksi (k) dan orde reaksi.
Persamaan laju reaksi atau yang disebut juga dengan hukum laju reaksi diperoleh melalui serangkaian eksperimen/percobaan. Dalam setiap percobaan, konsentrasi salah satu pereaksi diubah-ubah sedangkan konsentrasi pereaksi lain dibuat tetap. Secara umum, persamaan laju reaksi dari persamaan reaksi aA + bB → cC + dD adalah r = k[A]m[B]n.
Baca Juga: Rumus Kimia dari Suatu Senyawa
Bagaimana cara menentukan persamaan laju reaksi? Berapa besar nilai tetapan laju reaksi k pada suatu persamaan reaksi kimia? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Orde Reaksi dan Persamaan Laju Reaksi
- Langkah-Langkah Menentukan Persamaan Laju Reaksi
- Contoh Soal dan Pembahasan
Orde Reaksi dan Persamaan Laju Reaksi
Persamaan laju reaksi diperoleh dari hasil percobaan/eksperiman yang secara umum memiliki persamaan r = k[A]m[B]n. A dan B adalah zat pereaksi/reaktan, sehingga [A] = konsentrasi zat A dan [b] = konsentrasi zat B. Dengan r = laju reaksi, k = tetapan laju reaksi, dan m/n = orde (tingkat) reaksi pada pereaksi A/B.
Orde reaksi merupakan banyaknya faktor konsentrasi zat reaktan yang mempengaruhi kecepatan reaksi. Pada persamaan laju reaksi r = k[A]m[B]n nilai orde reaksi zat A adalah m dan nilai orde reaksi zat B adalah n. Orde reaksi suatu reaksi kimia sama dengan jumlah orde reaksi zat. Sehingga orde reaksi keseluruhan dari persamaan laju reaksi r = k[A]m[B]n adalah m + n.
Cara mementukan orde reaksi tidak dapat diturunkan dari persamaan reaksi tetapi hanya dapat ditentukan berdasarkan percobaan. Orde reaksi biasanya merupakan bilangan bulat 0, 1, 2, …, dan seterusnya. Namun ada juga orde reaksi dapat juga berupa bilangan pecahan atau negatif.
Langkah-Langkah Menentukan Persamaan Laju Reaksi
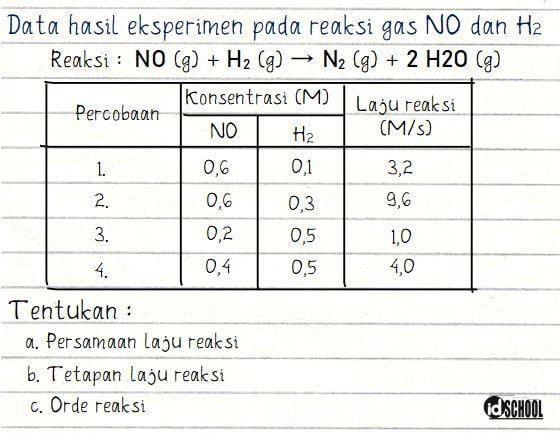
Contoh bagaimana cara mendapatkan orde reaksi, tetapan laju reaksi, dan bentuk persamaan laju reaksi akan diberikan dalam sebuah penyelesaian soal. Diperoleh data hasil suatu eksperimen pada reaksi gas NO dan H2 adalah sebagai berikut.
Langkah pertama yang dilakukan untuk menentukan persamaan laju reaksi keseluruhan dari reaksi tersebut adalah mencari orde untuk NO dan H2. Misalkan persamaan laju reaksi v = k [NO]m[H2]n, orde NO dan H2 berturut-turut adalah m dan n.
Nila m dapat diperoleh dari perbandingan dua data percobaan dengan nilai konsentrasi H2 yang sama. Kondisi ini terjadi pada percobaan 3 dan 4 di mana besar konstrasi H2 sama dengan 0,5 M. Cara mendapatkan nilai m (orde untuk NO) adalah sebagai berikut.
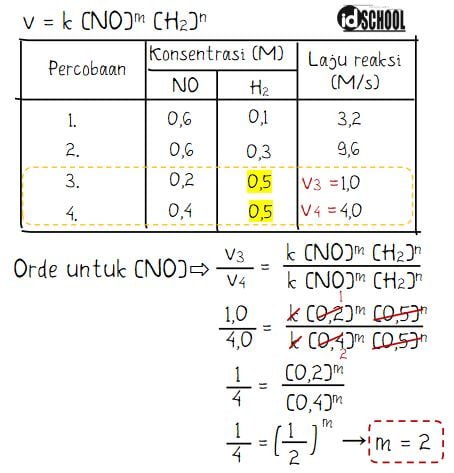
Dengan cara perhitungan yang sama, nilai orde n dapat diperoleh dari percobaan 1 dan 2. Di mana konsentrasi NO sama dengan 0,6 M.

Hasil perhitungan menghasilkan nilai orde untuk NO adalah m = 2 dan orde untuk H2 adalah n = 1. Sehingga, persamaan laju reaksi yang didapat adalah v = k [NO]2[H2].
Selanjtnya untuk menentukan tetapan laju reaksi k dilakukan dengan substitusi nilai data percobaan ke dalam persamaan v = k [NO]2[H2]. Data percobaan yang digunakan bisa data mana saja, sebagai contoh akan digunakan data hasil percobaan 1.
Menentukan tetapan laju reaksi (k):
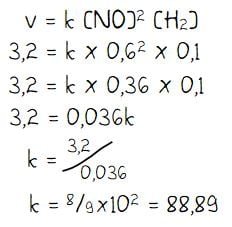
Dari proses perhitungan di atas dapat diperoleh beberapa hasil seperti berikut.
- Persamaan laju reaksi: v = k[NO]2[H2] = 8/9 × 102 [NO]2[H2]
- Besar tetapan laju reaksi: k = 8/9 × 102
- Orde reaksi = m + n = 2 + 1 = 3
Baca Juga: Penyetaraan Reaksi Kimia
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal dan Cara Menghitung Laju Reaksi
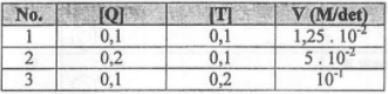
Berikut ini diberikan data percobaan lajur reaksi Q (g) + 2T (g) → T2Q (g) pada beberapa kondisi.
Jika [Q] dan [T] masing-masing diubah menjadi 0,5 M maka harga laju (v) reaksi saat itu adalah ….
A. 5,0
B. 7,5
C. 10,5
D. 12,5
E. 39,0
Pembahasan:
Untuk mendapatkan laju reaksi saat konsentrasi [Q] dan [T] sama dengan 0,5 molar perlu menentukan persamaan laju reaksi terlebih dahulu. Persmaan laju reaksi dapat diperoleh dari hasil percobaan yang dilakukan. Perhitungan yang perlu dilakukan memuat orde reaksi dan tetapan laju reaksi.
Perhitungan di bawah merupakan cara menentukan persamaan laju reaksi dengan orde reaksi dan persamaan laju.
Dari hasil perhitungan diperoleh persamaan laju reaksi v = 1.250 × [Q]2[T]3. Sehingga, saat konsentrasi Q dan T sama dengan 0,5 M persamaan laju reaksi v = 1,250×103× [0,5]2[0,5]3.
v = 1,25×103×[0,5]2[0,5]3
= 1,25×103×25×10-2×125×10-3
= 3.906,25×10-2 ≈ 39,0
Jadi, jika [Q] dan [T] masing-masing diubah menjadi 0,5 M maka harga laju (v) reaksi saat itu adalah 39,0.
Jawaban: E
Contoh 2 – Soal dan Cara Menghitung Laju Reaksi
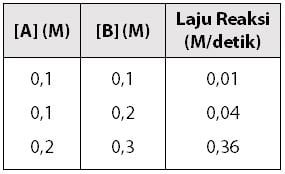
Diketahui reaksi: A + 2B → C
Dari percobaan, diperoleh data sebagai berikut.
Orde reaksi terhadap A dan B adalah ….
A. 1 dan 1
B. 1 dan 2
C. 2 dan 1
D. 2 dan 2
E. 2 dan 3
Pembahasan:
Pertama, menentukan orde reaksi untuk [B]:

Menentukan orde reaksi untuk [A]:

Jadi, orde reaksi terhadap A dan B adalah 2 dan 2.
Jawaban: D
Demikianlah tadi ulasan cara menghitung laju reaksi yang dilengkapi dengan contoh soal dan pembahasan. Terimakasih sudah mengunjungi idschoo(dot)net, semoga bermanfaat!