Hukum Perbandingan Volume diperkenalkan untuk pertama kalinya oleh Joseph Gay Lussac. Sehingga, hukum perbandingan volume juga biasa disebut hukum Gay Lussac. Kesimpulan yang kemudian termuat dalam hukum perbandingan volume ini didasarkan pada sebuah percobaan yang dilakukan oleh Lussac. Dari mana kesimpulan hukum perbandingan volume diperoleh? Bagaimana bunyi hukum perbandingan volume sebagai kesimpulan dari percobaan yang dilakukan oleh Lussac? Bagaimana hukum Gay Lussac dapat digunakan untuk menyelesaikan masalah?
Lussac meneliti tentang volume gas dalam suatu reaksi kimia. Berdasarkan penelitiannya, Lussac dapat mengambil kesimpulan bahwa perubahan volume gas dipengaruhi oleh suhu dan tekanan. Melalui percobaan yang dilakukannya, Gay Lussac mengenalkan hukum perbandingan volume. Percobaan sederhana yang dilakukan menghasilkan perbandingan volume hidrogen : oksigen : uap air adalah 2 : 1 : 2. Nampak bahwa perbandingan volume sesuai dengan perbandingan koefisien unsur atau senyawa pada persamaan reaksi setara, yaitu persamaan reaksi dengan jumlah atom di sebelah kiri sama dengan di sebelah kanan.

Baca Juga: Perhitungan Kimia – Konsep Mol
Bagaimana bunyi hukum perbandingan volume Gay Lussac? Bagaimana contoh soal hukum perbandingan volume dalam menyelesaikan masalah? Simak ulasan lebih lanjut mengenai hukum perbandingan volume gay lussac pada masing – masing pembahasan di bawah.
Table of Contents
Bunyi Hukum Perbandingan Volume Gay Lussac
Penemuan hukum perbandingan volume tidak lepas dari penemuan – penemuan penting terdahulu. Diawali pada awal tahun 1781, penemuan yang dikemukakan Joseph Priestley (1733 – 1804) menemukan hidrogen dapat bereaksi dengan oksigen membentuk air. Kemudian, Henry Cavendish (1731 – 1810) menemukan volume hidrogen dan oksigen yang bereaksi membentuk uap air mempunyai perbandingan 2 : 1.
Penelitian kemudian dilanjutkan oleh William Nicholson dan Anthony Carlise berhasil menguraikan air menjadi gas hidrogen dan oksigen melalui proses elektrolisis. Dari percobaan tersebut diperoleh hasil perbandingan volume hidrogen dan oksigen yang terbentuk 2 : 1.
Pada akhirnya, pada tahun 1808 Joseph Louis Gay Lussac (1778 –1850 ) berhasil mengukur volume uap air yang terbentuk dan diperoleh perbandingan volume hidrogen : oksigen : uap air adalah 2 : 1 : 2.
Bunyi hukum perbandingan volume (Hukum Gay Lussac):
Volume gas – gas yang bereaksi dan gas – gas hasil reaksi, bila diukur pada suhu dan tekanan yang sama berbanding sebagai bilangan yang bulat dan sederhana.

Perlu menjadi CATATAN penting bahwa hukum perbandingan volume tidak berlaku pada reaksi yang melibatkan zat dalam fase padat dan cair. Pada zat padat dan cair, koefisien reaksi hanya menyatakan perbandingan mol, tidak menyatakan perbandingan volume.
Untuk menambah pemahaman sobat idschool, perhatikan persoalan yang melibatkan hukum perbandingan volume Gay Lussac berikut.
Banyaknya volume gas hidrogen yang bereaksi dengan 16 liter gas oksigen dan menghasilkan uap air adalah ….
Contoh Soal Hukum Gay Lussac
Simak Pembahasannya berikut.
Persamaan reaksi hidrogen dan oksigen membentuk uap air dapat dituliskan seperti berikut.
H2 (g) + y O2 (g) → z H2O (g)
Namun, persamaan reaksi yang diberikan di atas belum setara. Ini dapat dilihat dari banyaknya unsur di sebelah kiri tanda panah tidak sama dengan unsur – unsur di sebelah kanan tanda panah. Untuk menentukan perbandingan volume kita harus mencari perbandingan koefisien gas dalam reaksi dalam keadaan persamaan yang setara.
Cara menyetarakan reaksi:
Pertama: pilih salah satu unsur atau senyawa kemudian beri angka 1 di depannya. Dalam persoalan ini dipilih uap air yang memiliki nilai koefisien 1. Pada bentuk persamaan reaksi yang cukup kompleks, disarankan memilih unsur/senyawa dengan bentuk paling sederhana. Namun, unsur/senyawa apapun yang dipilih, nantinya akan menghasilkan jawaban yang sama).
H2(g) + O2 (g) → 1 H2O (g)
Kedua: beri koefisien dengan variabel untuk unsur atau senyawa lainnya.
x H2(g) + y O2 (g) → 1 H2O (g)
Ketiga: samakan koefisien antara ruas kanan tanda panah dan ruas kiri tanda panah untuk menentukan nilai koefisien yang membuat reaksi menjadi persamaan setara.
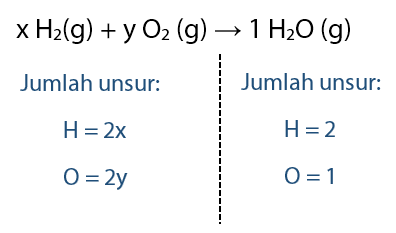
Akan diperoleh persamaan dari ruas kanan dan ruas kiri:
2x = 2 → x = 2/2 = 1
2y = 1 → y = 1/2
Keempat: diperoleh persamaan reaksi setara : H2 (g) + 1/2 O2 (g) → H2O (g)
Kelima: diperoleh perbandingan koefisien hidrogen : oksigen : uap air adalah H2 : O2 : H2O = 1 : 1/2 : 1 = 2 : 1 : 2.
Selanjutnya, jika terdapat gas oksigen 16 liter maka volume hidrogen yang diperlukan adalah 2/1 × 16 = 32 liter. Jadi, banyaknya volume gas hidrogen yang bereaksi dengan 16 liter gas oksigen dan menghasilkan uap air adalah 32 liter.
Baca Juga: Hukum Perbandingan Berganda (Hukum Dalton)
Contoh Soal Hukum Perbandingan Volume Gay Lussac
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Hukum Perbandingan Volume Gay Lussac
Pada persamaan reaksi yang belum setara berikut: SO2 (g) + O2 (g) → SO3 (g)
Perbandingan volume pereaksi dan hasil reaksi yang stoikiometri sesuai Hukum Gay Lussac adalah …. (Soal UN KIMIA SMA 2016)

Pembahasan:
Langkah pertama adalah membuat persamaan reaksi menjadi setara.

Menghitung nilai koefisien atau x dan y:
- Mencari nilai x:
2x + 2 = 3y
2x + 2 = 3x
3x – 2x = 2
x = 2
- Mencari nilai y:
y = x
y = 2
Sehingga persamaan reaksi yang setara adalah 2 SO2 (g) + O2 (g) → 2 SO3 (g). Jadi, perbandingan volume untuk reaksi tersebut adalah 2 : 1 : 2.
Selanjutnya, perhatikan pada pilihan yang diberikan. Perbandingan volume yang sesuai dengan perbandingan koefisien pada hasil tersebut adalah pilihan D.

Jawaban: D
Baca Juga: Hukum Perbandingan Tetap (Hukum Proust)
Contoh 2 – Soal Hukum Perbandingan Volume Gay Lussac
Sebanyak 5 liter gas hidrogen direaksikan dengan gas klorin dan menghasilkan gas hidrogen klorida (HCI) maka volume gas HCl yang dihasilkan pada P dan T yang sama adalah ….
A. 2,5 liter
B. 5 liter
C. 7,5 liter
D. 10 liter
E. 12,5 liter
Pembahasan:
Langkah pertama adalah mengetahui persamaan reaksi berdasarkan contoh soal yang diberikan di atas.
H2 (g) + Cl2 (g) → HCL (g)
Perhatikan bahwa persamaan reaksi di atas bukan reaksi setara, sehingga perlu menyetarakan reaksi tersebut agar bisa diketahui perbandingan volumenya.
1 H2 (g) + x Cl2 (g) → y HCl(g)
Ruas kiri:
H = 2
Cl = 2x
Ruas kanan:
H = y
Cl = y
Menghitung nilai y: (menyamakan koefisien unsur yang sama pada ruas kiri dan kanan)
y = 2
Menghitung nilai x:
2x = y
2x = 2
x = 2/2 = 1
Persamaan reaksi setara: H2 (g) + Cl2 (g) → 2 HCl(g)
Diperoleh perbandingan gas H : Cl : HCl adalah 1 : 1 : 2.
Diketahui banyaknya gas hidrogen dalam reaksi adalah 5 liter. Sehingga, volume gas HCl yang dihasilkan pada P dan T yang sama adalah = 2/1 × 5 = 10 liter.
Jawaban: D
Demikianlah ulasan materi hukum perbandingan volume gay lussac yang meliputi bunyi hukum gay lussac dan contoh soal hukum perbandingan Gay Lussac beserta dengan pembahasannya. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Sifat Periodik Unsur
