Rumus pH campuran dan cara menghitung pH campuran dibutuhkan pada persoalan reaksi asam-basa. Di mana, larutan asam yang bereaksi dengan larutan basa akan menghasilkan garam dan air. Dari campuran dua jenis larutan tersebut akan memiliki harga pH baru yang merupakan pH campuran.
Larutan campuran asam dan basa dapat berasal dari asam kuat dengan basa kuat atau basa lemah. Larutan campuran asam basa juga dapat berasal dari basa kuat dengan asam lemah. Atau, larutan campuran asam basa bisa juga berasal dari asam lemah dan basa lemah. Cara menghitung pH campuran bergantung pada konsentrasi H+ atau OH– yang terdapat pada sisa reaksi dari asam kuat/lemah atau basa kuat/lemah. Sehingga pengetahuan akan sifat larutan asam dan basa sangat dibutuhkan.

Bagaimana pH campuran dari larutan dengan sisa reaksi terdapat pada larutan asam/basa kuat? Bagaimana dengan pH campuran untuk sisa reaksi pada larutan asam/basa lemah? Lalu bagaimana jika tidak ada sisa pada reaksi yang terjadi? Sobat idschool dapat mencari tahu jawabannya melalui ualasan di bawah.
Baca Juga: Rumus Kadar Zat dan Unsur dalam Senyawa/Larutan
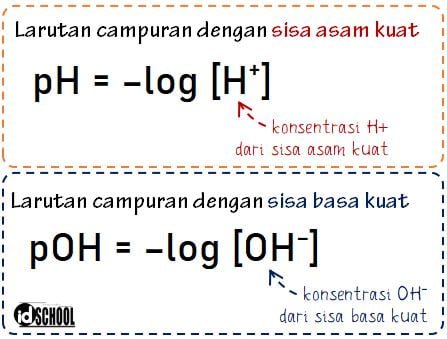
Rumus pH Campuran Larutan dengan Sisa Larutan Asam/Basa Kuat
Harga pH campuran pada reaksi antara larutan asam kuat dan basa kuat diperoleh dari konsentrasi H+ atau OH– sisa asam/basa kuat. Campuran larutan asam basa dengan sisa larutan asam/basa kuat dapat berasal dari asam kuat + basa kuat, asam kuat + basa lemah, atau asam lemah dan basa kuat.
Jika sisa reaksi merupakan asam kuat maka akan didapat nilai pH dari persamaan pH = –log [H+]. Jika sisa reaksi merupakan basa kuat maka akan didapat nilai pOH dari persamaan pOH = –log [OH–]. Selanjtunya, nilai pOH dapat digunakan untuk menghitung nilai pH larutan melalui rumus pH = 14 – pOH.
Sedangkan pada reaksi asam kuat dan basa kuat yang keduanya habis bereaksi akan menghasilkan pH campuran sama dengan 7. Harga pH = 7 menunjukkan bahwa larutan campuran memiliki sifat netral.
Contoh Cara Menghitung pH Campuran dengan Sisa Asam/Basa Kuat:
Contoh cara menghitung pH campuran dengan kondisi sisa larutan dari asam atau basa kuat diberikan seperti persoalan di bawah.
Soal 1: Tentukan pH campuran pada 50 mL larutan HCl 0,5 M yang direaksikan dengan 50 mL NaOH 0,1 M.
Larutan HCl diketahui merupakan asam kuat dan NaOH diketahui merupakan basa kuat. Untuk menghitung pH campuran dari kedua larutan tersebut perlu mengetahui berapa sisa HCl atau NaOH. Sebelumnya tentukan dahulu konsentrasi HCl dan NaOH terlebih dahulu.
Menghitung mol dari 50 mL HCl 0,5 M:
mol = M×V
mol = 0,5×50 = 25 mmol
Menghitung mol dari 50 mL NaOH 0,1 M:
mol = M×V
mol = 0,1×50 = 5 mmol
Menentukan sisa reaksi:
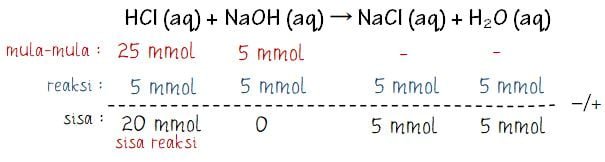
Dari hasil perhitungan di atas dapat diketahui bahwa sisa reaksi adalah HCl (asam kuat) sebanyak 20 mmol.
Konsentrasi sisa HCl:
M = n/V
M = 20/100 = 0,2 = 2×10–1
Menghitung pH campuran:
pH = –log[2×10–1]
pH = –log 2 + –log(10–1) = –log 2 + 1
Jadi, pH campuran pada 50 mL larutan HCl 0,5 M yang direaksikan dengan 50 mL NaOH 0,1 M adalah –log 2 + 1 atau 1– log 2.
Baca Juga: Cara Pemekatan/Pengenceran pada Pencampuran 2 Larutan Sejenis Berbeda Konsentrasi
Rumus pH Campuran Larutan dengan Sisa Larutan Asam/Basa Lemah (Dapar/Penyangga/Buffer)
Sisa reaksi pada campuran larutan asam basa juga dapat berasal dari asam atau basa lemah. Reaksi yang menghasilkan sisa asam atau basa lemah disebut dengan larutan penyangga/dapar atau larutan buffer. Kondisi ini dapat terjadi pada pencampuran larutan asam kuat dengan basa lemah, asam lemah dengan basa kuat, atau asam lemah dengan basa lemah.
Untuk menghitung pH campuran dengan sisa reaksi dari larutan asam lemah menggunakan rumus konsentrasi H+ atau OH– seperti berikut.
Contoh Cara Menghitung pH Campuran dengan Sisa Asam/Basa Lemah
Soal 2: Campuran 100 ml larutan NH3 0,2 M dengan 50 ml larutan H2SO4 0,1 M. Jika diketahui Kb NH3 = 1×10–6 maka tentukan harga pH campuran larutan tersebut!
Penyelesaian:
Diketahui bahwa NH3 adalah larutan basa lemah dan H2SO4 adalah larutan asam kuat. Perhitungan harga pH campuran kedua larutan tersebut didahului dengan mencari larutan mana yang mempunyai sisa reaksi.
Menghitung jumlah mol (n) NH3 awal:
n = M×V
n = 0,2×100 = 20 mmol
Menghitung mol H2SO4:
n = M×V
n = 0,1×50 = 5 mmol
Mencari sisa dan hasil reaksi:

Hasil akhir menunjukkan bahwa NH3 (basa lemah) memiliki sisa reaksi sebanyak 15 mmol. Sedangkan larutan garam yang terbentuk memilki jumlah mol sebanyak 5 mmol. Selanjutnya, konsentrasi OH– dapat dihitung melalui cara di bawah.

Menghitung nilai pOH dan pH larutan campuran:
- pOH = –log(10–6)
pOH = 6 - pH = 14 – pOH
pH = 14 – 6 = 9
Jadi, pH campuran 100 ml larutan NH3 0,2 M dengan 50 ml larutan H2SO4 0,1 M sama dengan 9.
Baca Juga: 3 Konsep Teori Asam Basa
Rumus pH Campuran Larutan Tanpa Sisa Reaksi (Hidrolisis)
Campuran larutan asam dan basa yang tidak terdapat sisa reaksi disebut dengan hidrolisis. Ada tiga kondisi yang perlu diperhatikan pada hidrolisis untuk menentukan harga pH campuran larutan. Kondisi tersebut memperhatikan garam yang terbentuk dari larutan asam kuat dengan basa lemah, asam lemah dengan basa kuat, atau dari asam lemah dengan basa lemah.
Jika garam yang berasal dari larutan asam kuat dan basa lemah maka menggunakan rumus konsentrasi H+. Jika garam yang berasal dari larutan asam lemah dan basa kuat maka menggunakan rumus konsentrasi OH–. Pada garam yang terbentuk dari asam lemah dan basa lemah mengalami hidolisis sempurna. Rumus pH campuran larutan dari asam lemah dan basah lemah menggunakan konsentrasi H+.
Rumus konsentrasi H+ atau OH– untuk menghitung pH campuran larutan yang tidak memiliki sisa menggunakan persamaan berikut.
Keterangan:
[H+] = konsentrasi H+
[OH–] = konsentrasi OH–
[G] = konsentrasi garam
Ka = tetapan kesetimbangan larutan asam
Kb = tetapan kesetimbangan larutan basa
Kw = tetapan kesetimbangan air (Kw = 10–14)
Setelah mendapatkan nilai konsentrasi H+ atau OH– selanjutnya dapat diperoleh harga pH melalui rumus pH.
Contoh Cara Menghitung pH Campuran Larutan yang Habis Bereaksi (Tidak Ada Sisa)
Soal 3: Sebanyak 100 mL H2SO4 0,1 M dicampur dengan 100 mL larutan NH3 0,2 M. Jika Kb NH3 = 1×10–5 maka pH campuran yang terbentuk adalah ….
Pembahasan:
Larutan H2SO4 adalah asam kuat dan NH3 adalah larutan basa lemah. Langkah pertama adalah mengetahui larutan mana yang memiliki sisa reaksi atau tidak memiliki sisa reaksi.
Menghitung jumlah mol (n) H2SO4:
n = M×V
n = 0,1×100 = 10 mmol
Menghitung jumlah mol (n) NH3:
n = M×V
n = 0,2×100 = 20 mmol
Menentukan larutan yang memiliki sisa reaksi:

Hasil perhitungan di atas menunjukkan bahwa larutan habis bereaksi yang menghasilkan garam sebanyak 10 mmol. Sehingga konsentrasi H+ pada campuran larutan tersebut dapat dihitung melalui cara di bawah.
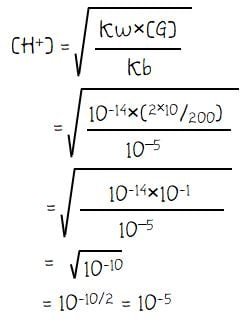
Menghitung pH campuran larutan:
pH = –log[H+]
pH = –log[10–5] = 5
Jadi, harga pH campuran yang terbentuk adalah 5.
Demikianlah tadi ulasan bagaimana rumus dan cara hitung pH campuran larutan dengan berbagai kondisi. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Rumus Tetapan Kesetimbangan Kc dan Kp