Larutan penyangga adalah hasil campuran larutan dari larutan asam dan basa yang salah satu atau keduanya merupakan larutan asam/basa lemah. Di mana larutan asam/basa lemah memiliki sisa reaksi sejumlah mol. Cara menghitung pH larutan penyangga dapat dilakukan melalui rumus pH = –log[H+] atau pOH = –log[OH–]. Dengan besar konsentrasi H+ dan OH– pada larutan penyangga dihitung melalui suatu persamaan/rumus.
Larutan penyangga disebut juga dengan larutan buffer yaitu larutan yang dapat mempertahankan pH. Dengan kata lain, larutan buffer memiliki pH yang konstan terhadap pengaruh sedikit pengenceran atau penambahan sedikit asam/basa. Larutan penyangga atau larutan buffer dapat ditandai melalui adanya sisa reaksi larutan asam/basa lemah pada pereaksi/reaktan.
Bagaimana rumus konsentrasi H+ dan OH– pada larutan penyangga? Bagaimana cara menghitung pH larutan penyangga? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: Rumus Derajat Ionisasi Asam Basa
Rumus Konsentrasi H+ dan OH– Larutan Penyangga
Larutan penyangga meliputi dua macam yaitu campuran asam lemah dengan basa konjugasi dan basa lemah dengan asam konjugasi.
Larutan penyangga yang mengandung campuran asam lemah dan basa konjugasinya memiliki konsentrasi H+. Sedangkan pada larutan bufer yang mengandung campuran basa lemah dan asam konjugasinya memiliki konsentrasi OH-. Dari konsentrasi H+ atau OH- tersebut kemudian dapat ditentukan nilai pH larutan penyangga.
Konsentrasi H+ dan OH– pada larutan penyangga dapat dihitung melalui rumus konsentrasi berikut.
Baca Juga: Cara Membaca/Menyimpulkan Hasil Indikator Asam Basa
Langkah-Langkah untuk Menghitung pH Larutan Penyangga
Cara menghitung pH larutan penyangga pada umumnya sama dengan cara menghitung pH larutan seperti biasanya. Di mana langkah-langkan untuk menghitung pH larutan didahului dengan menghitung konsentrasi H+ atau OH– terlebih dahulu.
Beberapa langkah menghitung pH larutan penyangga meliputi:
- Menghitung banyak mol zat-zat pereaksi
- Menentukan sisa banyak mol dari zat-zat yang bereaksi
- Mementukan konsentrasi H+ atau OH–
- Menghitung pH larutan
Sebagai contoh, perhatikan langkah-langkah menghitung pH larutan penyangga pada penyelesaian soal berikut.
Soal: Sebanyak 300 mL larutan CH3COOH 0,1 M (Ka CH3COOH = 10–5) dicampur 50 mL larutan NaOH 0,2 M. Tentukan pH larutan tersebut!
Penyelesaian:
Langkah 1: menghitung banyak mol pereaksi
- Banyak mol CH3COOH:
n = M×V
n = 0,1×300 = 30 mmol
- Banyak mol NaOH:
n = M×V
n = 0,2×50 = 10 mmol
Langkah 2: menghitung sisa mol pereaksi yang merupakan asam/basa lemah
Hasil perhitungan diperoleh bahwa CH3COOH (asam lemah) memiliki sisa reaksi sejumlah 20 mmol. Jumlah mol basa konjugat yang terbentuk sebanyak 10 mmol. Selanjutnya dapat dihitung besar konsentrasi H+ dari larutan penyangga.
Langkah 3: Mementukan konsentrasi H+ atau OH–
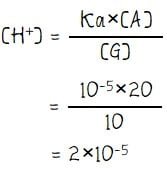
Langkah 4: menghitung pH larutan
pH = –log[H+]
pH = –log[2×10–5] = 5 – log 2
Jadi, pH larutan campuran 300 mL larutan CH3COOH 0,1 M dan 50 mL larutan NaOH 0,2 M adalah 5 – log 2.
Baca Juga: Cara Menentukan Arah Pergeseran Kesetimbangan Reaksi Kimia
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschoo dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal pH Larutan Penyangga
Sebanyak 20 mL larutan NH3 0,30 M (Kb = 10–5) dicampur dengan 40 mL larutan HCl 0,10 M. Harga pH campuran larutan tersebut adalah .…
A. 6 – log 5
B. 6 + log 5
C. log 5 – 8
D. 8 – log 5
E. 8 + log 5
Pembahasan:
Menghitung jumlah mol NH3:
nNH3 = M×V
nNH3 = 0,30×20 = 6 mmol
Menghitung jumlah mol HCl:
nHCl = M×V
nHCl = 0,10×40 = 4 mmol
Stokiometri: menentukan sisa mol pereaksi
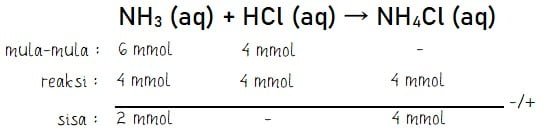
Hasil perhitungan memberikan informasi bahwa pereaksi yang memiliki sisa reaksi adalah NH3 sebanyak 2 mmol. Larutan NH3 merupakan basa lemah sehingga konsentrasi OH– dapat dihitung menggunakan cara seperti di bawah.
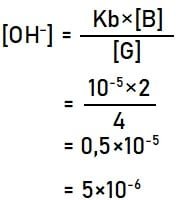
Menghitung pOH larutan:
pOH = –log[OH–]
pOH = –log[5×10–6] = 6 – log 5
Menghitung pH larutan:
pH = 14 – pOH
pH = 14 – (6 – log 5) = 8 + log 5
Jadi, harga pH larutan penyangga tersebut adalah 8 + log 5.
Jawaban: E
Contoh 2 – Soal pH Larutan Penyangga
Dalam 1 liter larutan penyangga dengan 0,5 M NH3 ditambahkan NH4Cl sehingga pH larutan menjadi 10. Jika Kb NH3 = 1×10–5 maka jumlah mol NH4Cl yang ditambahkan adalah ….
A. 0,055
B. 0,005
C. 0,55
D. 0,05
E. 0,5
Baca Juga: Apa itu Kesetimbangan Kimia?
Pembahasan:
Diketahui pH larutan setelah ditambahkan NH4Cl adalah pH 10, sehingga pOH = 14 – pH = 14 – 10 = 4.
Menghitung kosentrasi OH– :
pOH = 4
–log[OH–] = 4
[OH–] = 10–4
Menhtiung mol NH4Cl yang ditambahkan:

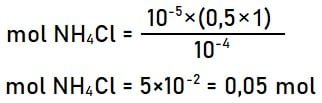
Jadi, jumlah mol NH4Cl yang ditambahkan adalah 0,05.
Jawaban: D
Contoh 3 – pH campuran Larutan Penyangga
Sebanyak 100 mL larutan penyangga mengandung NH3 0,1 M (Kb =10–5) dan NH4Cl 0,1 M. Jika ditambahkan 1 mL HCl 0,1 M maka pH campuran larutan penyangga tersebut menjadi .…
A. 8 + log 9,8
B. 8 – log 9,8
C. 8 – log 8,9
D. 6 + log 9,8
E. 6 – log 9,8
Pembahasan:
Menentukan jumlah mol NH3, NH4Cl, dan HCl:
- Jumlah mol NH3:
nNH3 = M×V
nNH3 = 0,1×100 = 10 mmol
- Jumlah mol NH4Cl:
nNH3 = M×V
nNH3 = 0,1×100 = 10 mmol
- Banyak mol HCl:
nHCl = M×V
nHCl = 0,1×100 = 10 mmol
Stokiometri: menghitung jumlah mol basa lemah yang bersisa
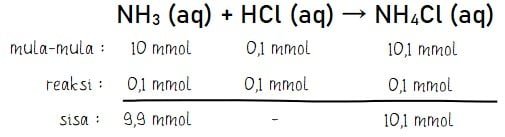
Menghitung konsentrasi OH– campuran larutan penyangga/buffer:
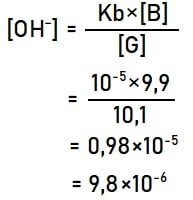
Menghitung pOH larutan:
pOH = –log[OH–]
pOH = –log[9,8×10–6] = 6 – log 9,8
Menghitung pH larutan:
pH = 14 – pOH
pH = 14 – (6 – log 9,8) = 8 + log 9,8
Jadi, pH campuran larutan penyangga tersebut menjadi 8 + log 9,8.
Jawaban: A
Demikianlah tadi ulasan cara menghitung pH larutan penyangga. Terimakasi sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Perubahan Entalpi pada Suatu Reaksi Kimia



