Cara menentukan bilangan oksidasi pada unsur, ion, atau molekul (senyawa) mengikuti aturan IUPAC. Singkatan dari International Union Pura and Applied Chemistry. Bilangan oksidasi biasa disingkat sebagai biloks. Adalah jumlah muatan yang dimiliki atom suatu unsur jika bergabung dengan atom unsur lain.
Bilangan oksidasi menunjukkan kemampuan untuk melepas atau menangkap elektron dari atom. Bilangan oksidasi dituliskan lengkah dengan tanda positif (+) dan negatif (–). Contohnya +3, +2, +1, 0, –1, –2, dan lain sebagainya.
Detail cara menentukan bilangan oksidasi ada di bawah.
Daftar isi:
- Bilangan Oksidasi
- Aturan untuk Menentukan Bilangan Oksidasi
- Contoh Soal Cara Menentukan Bilangan Oksidasi
Bilangan Oksidasi
Bilangan oksidasi (biloks) adalah jumlah muatan yang dimiliki atom suatu unsur jika bergabung dengan atom unsur lain. Biloks berkaitan dengan materi reaksi oksidasi – reduksi atau reaksi redoks. Sehingga, bahasan ini akan diberikan sebelum memelajari reaksi redoks.
Suatu atom memiliki strukturkecenderungan agar berada dalam keadaan stabil. Dengan cara menyerupai struktur atom gas mulia. Caranya dengan melepas atau menangkap elektron. Sehingga menjadi atom yang bermuatan.
Misalnya atom Mg yang melepaskan dua elektron menjadi Mg2+. Contoh lain, atom S yang menerima dua elektron menjadi S2-.

Baca Juga: Hukum Perbandingan Berganda – Dalton
Penjelasan untuk menentukan bilangan oksidasi dibahas pada aturan di bawah.
Aturan untuk Menentukan Bilangan Oksidasi
Setidaknya ada 10 aturan yang perlu diketahui pada cara menentukan bilangan oksidasi. Aturan atau ketentuan bilangan oksidasi (biloks) diberikan seperti berikut.

Aturan 1:
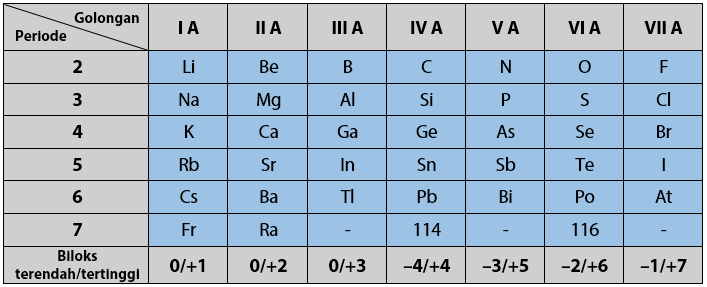
Bilangan oksidasi unsur bebas adalah nol. Contoh: biloks C, Ne, Cu, Fe, Na = 0; biloks H2, O2, Cl2, P4, S8 = 0.
Aturan 2:
Bilangan oksidasi Oksigen (O) dalam senyawanya adalah –2 kecuali dalam peroksida (biloks O = –1), dalam senyawa biner fluorida (biloks O = + 2), atau dalam senyawa superoksida (biloks O = ‒1/2).
Contoh: biloks O dalam H2O adalah –2; O dalam H2O2 dan BaO2 adalah –1; O dalam OF2 adalah +2; dan biloks O dalam KO2 adalah ‒1/2.
Aturan 3:
Bilangan oksidasi hidrogen dalam senyawanya adalah + 1, kecuali bilangan oksidasi hidrogen dalam senyawa hidrida (senyawa yang terbentuk jika logam bergabung dengan atom H , seperti NaH, KH, CaH2) adalah – 1.
Contoh:
biloks H dalam H2O, NH3, atau HCl = +1
biloks H dalam NaH, KH, atau CaH2 = –1
Aturan 4:
Bilangan oksidasi unsur golongan logam I A dan II A dalam senyawa pada umumnya selalu positif dan sesuai dengan golongannya.
Biloks unsur logam golongan I A (Li, Na, K, Rb, Cs, Fr) adalah + 1. Contoh: biloks K pada senyawa KCl/KNO3/K2SO4 adalah +1.
Bilangan oksidasi unsur logam golongan IIA (Be, Mg, Ca, Sr, Ba, Ra) adalah + 2. Contoh: biloks Mg pada senyawa MgO/MgCl2/MgSO2 adalah +2.
Aturan 5:
Bilangan oksidasi unsur ion sesuai dengan jenis muatan ion dan jumlahnya. Contoh: biloks Na+ = +1; biloks Mg2+ = +2; biloks S2- = –2.
Bilangan oksidasi senyawa atau molekul adalah nol. Contoh: Jumlah bilangan oksidasi H2S adalah 0.
Sehingga,
Σb. o. H2S = 0
2 × b.o. H + 1 × b. o. S = 0
Jumlah bilangan oksidasi (b.o.) NH3 adalah 0.
Sehingga,
Σb. o. NH3 = 0
1 × b. o. N + 3 × b. o. H = 0
Aturan 6:
Bilangan oksidasi senyawa atau molekul ion adalah sesuai dengan jenis muatan dan jumlahnya. Contoh: Jumlah bilangan oksidasi (b. o.) NH4+1 adalah + 1.
Sehingga,
Σb. o. NH4+1 = +1
1 × b.o. N + 4 × b.o. H = 0
Contoh lain, jumlah bilangan oksidasi (b. o.) CO3–2 adalah –2.
Sehingga,
Σb. o. CO3–2 = –2
1 × b. o. C + 3 × b. o. O = –2
Aturan 7:
Biloks unsur halogen mempunyai nilai lebih dari satu. Contoh biloks F = 0, –1 atau F = 0, –1, +1, +3, +5, +7. Contoh lain, biloks Br = 0, –1, +1, +5, +7 dan biloks I = 0, –1, +1, +5, +7.
Aturan 8:
Bilangan oksidasi F dalam senyawanya selalu sama dengan – 1. Contoh: biloks F dalam NaF = –1 dan biloks F dalam BrF = –1.
Aturan 9:
Bilangan oksidasi atom non logam dalam senyawa binernya jika berikatan dengan atom logam sama dengan muatan ionnya. Contoh: biloks S dalam H2S = –2 dan biloks Cl dalam KCl = –1.
Aturan 10:
Bilangan oksidasi atom non logam yang lebih elektronegatif dalam senyawa binernya jika berikatan dengan atom non logam sama dengan muatan ionnya. Contoh: biloks Cl dalam ICl = –1 karena Cl lebih elektronegatif dari pada I.
Tabel bilangan oksidasi tertinggi dan terendah:
Baca Juga: Konsep Mol dalam Perhitungan Kimia
Contoh Soal Cara Menentukan Bilangan Oksidasi
Beberapa soal yang bisa digunakan sebagai cara menentukan bilangan oksidasi ada di bawah.
Contoh 1 – Unsur yang mempunyai bilangan oksidasi yang sama dengan Cl dalam HClOO3
Unsur yang mempunyai bilangan oksidasi yang sama dengan unsur Cl di dalam HClO3 adalah ….
A. Cr dalam ion CrO42–
B. Fe dalam ion Fe(CN)63–
C. Cr dalam ion CrO72–
D. Sb dalam ion SBO43–
E. Mn dalam ion MnO41–
Pembahasan:
Ada tiga aturan yang akan digunakan untuk menentukan bilangan oksidasi yang sama dengan unsur Cl di dalam HClO3. Yaitu,
- Jumlah bilangan oksidasi senyawa atau molekul adalah nol.
- Bilangan oksidasi hidrogen dalam senyawanya adalah +1.
- Bilangan oksidasi Oksigen (O) dalam senyawanya adalah –2.
Menentukan biloks Cl:
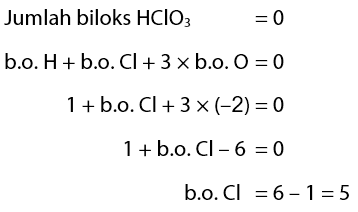
Selanjutnya akan dicari biloks pada lima pilihan yang diberikan
- Pilihan A: Cr dalam CrO42–
bo Cr + 4 × bo O = ‒2
bo Cr + 4×(‒2) = ‒2
bo Cr = ‒2 + 8 = 6
- Pilihan B: Fe dalam Fe(CN)63–
bo Fe + 6 × bo CN = ‒3
bo Fe + 6×(‒1) = ‒3
bo Fe = ‒3 + 6 = 3
- Pilihan C: Cr dalam CrO72–
bo Cr + 7 × bo O = ‒2
bo Cr + 7×(‒2) = ‒2
bo Cr = ‒2 + 14 = 12
- Pilihan D: Sb dalam ion SbO43–
bo Sb + 4 × bo O = ‒3
bo Sb + 4 × (‒2) = ‒3
bo Sb = ‒3 + 8 = 5
- Pilihan E: Mn dalam ion MnO41–
bo Mn + 4 × bo O = ‒1
bo Mn + 4 × (‒2) = ‒1
bo Mn = ‒2 + 8 = 6
Jadi, unsur yang mempunyai bilangan oksidasi sama dengan unsur Cl di dalam HClO3 adalah Sb dalam ion SBO43–.
Jawaban: D
Contoh 2 – Bilangan oksidasi Mn tertinggi terdapat pada senyawa
Bilangan oksidasi Mn tertinggi terdapat pada senyawa ….
A. MnO2
B. Mn2O3
C. Mn3O4
D. KMnO4
E. K2MnO4
Pembahasan:
Aturan yang digunakan untuk mengetahui biloks senyawa MnO2, Mn2O3, Mn3O4, KMnO4, dan K2MnO4:
1) Biloks senyawa atau molekul adalah nol,
2) Biloks unsur golongan logam I A dan II A dalam senyawa pada umumnya selalu positif dan sesuai dengan golongannya.
3) Biloks oksigen (O) dalam senyawanya adalah –2.
Cara menentukan bilangan oksidasi untuk senyawa-senyawa tersebut sesuai pada penyelesaian di bawah,
Cara menentukan bilangan oksidasi pada senyawa MnO2:
Pertama, biloks O = 2×(–2) = –4 karena ada dua unsur O (biloks O pada senyawa = –2). Agar jumlah biloks senyama sama dengan mol, dengan begitu biloks Mn = +4.

Dari hasil perhitungan diperoleh bahwa biloks Mn pada senyawa MnO2 adalah +4. Cara menentukan bilangan oksidasi Mn pada senyawa Mn2O3, Mn3O4, KMnO4, dan K2MnO4 dilakukan seperti pada cara berikut.

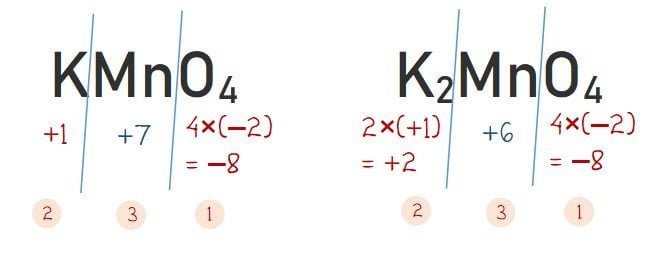
Diperoleh biloks Mn pada senyawa MnO2, Mn2O3, Mn3O4, KMnO4, dan K2MnO4 berturut-turut adalah +4, +3, +8/3, +7, dan + 6.
Jadi, bilangan oksidasi Mn tertinggi terdapat pada senyawa KMnO4.
Jawaban: D
Demikianlah ulasan cara menentukan bilangan oksidasi dan contoh soalnya. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Perhitungan Kimia – Konsep Mol
