Konsep Mol menyatakan hubungan antara mol dengan jumlah partikel, massa, molaritas, dan volume. Mol adalah satuan hitung yang menyatakan banyak partikel pada 12 gram atom C-12 dalam sejumlah zat. Nilai 1 mol = 6,02 × 1023 partikel, disebut sebagai bilangan Avogadro. Lambang bilangan Avogadro adalah huruf L atau N.
Rumus konsep mol terdapat pada diagram berikut.
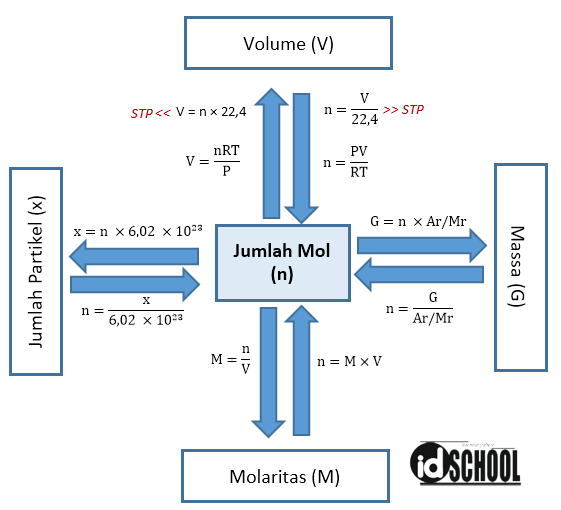
Lebih lanjut mengenai konsep mol ada pada penjelasan di bawah.
Daftar isi:
Rumus Konsep Mol
Rumus konsep mol meliputi hubungan mol dengan jumlah partikel, massa, volume, dan molaritas. Keempat rumus konsep mol dijelaskan seperti berikut.
Jumlah Partikel (x)
Jumlah partikel dalam satu mol senyawa adalah 6,02 × 1023 partikel. Maka jumlah partikel dalam 2 mol senyawa tersebut adalah 2 × 6,02 × 1023 = 12,04 × 1023 partikel. Bentuk partikel dapat berupa atom, molekul, atau ion.
Sebagai contoh, untuk 1 mol unsur Fe = 6,02 × 1023 atom Fe. Contoh lainnya, untuk 1 mol O2 = 6,02 × 1023 molekul O2. Rumus jumlah partikel untuk n mol unsur, senyawa, atau zat dinyatakan dalam persamaan berikut.
X = n × L
Keterangan:
X = jumlah partikel
n = jumlah mol
L = bilangan Avogadro = 6,02 × 1023
Perhatikan contoh soal di bawah untuk melihat cara menggunakan rumus di atas.
Soal:
Jumlah atom H, S, dan O dalam 5 mol asam sulfat adalah ….
Jawab:
Rumus kimia dari senyawa asam sulfat adalah H2SO4. Banyak atom H, S, dan O dalam senyawa asam sulfat berturut-turut adalah 2, 1, dan 4.
Rumus jumlah atom = banyak atom × mol × L
Sehingga, jumlah atom:
H = 2 × 5 × 6,02 × 1023 = 6,02 × 1024
S = 1 × 5 × 6,02 × 1023 = 3,01 × 1024
O = 4 × 5 × 6,02 × 1023 = 12,04 × 1024
Baca Juga: Sifat Periodik Unsur
Massa (Gr)
Massa satu mol zat dinamakan massa molar. Besar massa molar ama dengan massa atom relatif atau massa molekul relatif zat yang dinyatakan dalam satuan gram per mol. Untuk massa molekul atau senyawa sama dengan perkalian massa molar (g/mol) dengan mol (n) senyawa.
Rumus massa:

Keterangan:
Gr = massa molekul/senyama
n = jumlah mol
Ar = massa atom relatif
Mr = massa molekul relatif
Contoh cara menghitung massa ada di bawah.
Soal:
Massa untuk 0,1 mol urea (CO(NH2)2) adalah …. (Ar H = 1, C = 12, N = 14, O = 16)
Jawab:
Menghitung Mr CO(NH2)2 = Ar C + Ar O + 2 × Ar N + 4 × Ar H = 12 + 16 + 2 × 14 + 4 × 1 = 12 + 16 + 28 + 4 = 60
Menghitung massa CO(NH2)2:
Massa CO(NH2)2 = n × Mr CO(NH2)2
= 0,1 × 60
= 6 gram
Baca Juga: Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
Volume
Untuk menghitung volume dibedakan menjadi dua kondisi. Yaitu kondisi STP dan non STP. Perbedaan keduanya ada pada penjelasan di bawah.
Keadaan STP
Keadaan STP (Standard Temperature and Pressure) adalah kondisi saat suhu 0° C dan tekanan 1 atm atau 76 cmHg (760 mmHg). Volume gas pada kondisi STP sama dengan jumlah mol gas dikali 22,4 liter. Persamaan ini diperoleh dari percobaan Avogadro.
Rumus volume pada kondisi STP:

Rumus volume digunakan untuk menyelesaikan contoh soal di bawah.
Soal:
Diketahui gas CO2 dengan massa sama dengan 22 gram. Jika diukur pada tekanaan 1 atm maka volume gas CO2 tersebut adalah …. (Ar C = 12, O = 16)
Jawab:
Dari soal diketahui massa gas CO2 adalah 22 gram (Gr CO2 = 22 gram) dan dihitung Mr CO2 = Ar C + 2 × Ar O = 12 + 2 × 16 = 12 + 32 = 44 gram/mol.
Mol CO2:
Menghitung Volume gas CO2 (STP):
V = n × 22,4
V = 0,5 × 22,4 = 11,2 liter
Jadi, volume 22 gram gas CO2 pada keadaan STP adalah 11,2 liter.
Keadaan Non STP
Keadaan non STP adalah kondisi di luar STP. Yaitu kondisi yang diukur tidak pada suhu 0° C dan tekanan 1 atm. Rumus volume gas yang diukur pada kondisi non STP ada di bawah.

Jika terdapat perbandingan mol dan volume dari dua jenis gas berbeda berlaku perpandingan senilai.
Contoh cara menghitung volume gas yang diukur pada keadaan non STP ada pada penyelesaian soal di bawah.
Soal:
Diketahui volume gas metana (CH4) memiliki massa 4 gram. Jika diukur pada keadaan yang sama untuk 3 gram NO dengan volume 5 L maka volume gas metana tersebut adalah …. (Ar: H = 1, C = 12, N = 14, O = 16)
Jawab:
Dari keterangan yang diberikan pada soal dapat diperoleh informasi-informasi berikut.
- Massa gas metana (CH4): G CH4 = 4 gram
- Massa NO: G NO = 3 gram
- Volume NO: VNO = 5 L
- Ar: H = 1, C = 12, N = 14, O = 16
Mr CH4 = Ar C + 4 × Ar H = 12 + 4 × 1 = 12 + 4 = 16 gram/mol
Mol CH4:
Mr NO = Ar N + Ar O = 14 + 16 = 30 gram/mol
Mol NO:
Menghitung volume CH4:
Jadi, volume gas metana jika diukur pada keadaan yang sama untuk 3 gram NO dengan volume 5 liter adalah 12,5 liter.
Baca Juga: Hukum Perbandingan Tetap [Hukum Proust]
Molaritas
Molaritas menyatakan konsentrasi larutan yaitu banyaknya mol zat dalam 1 L larutan. Rumus molaritas diberikan pada persamaan di bawah.

Contoh cara menghitung molaritas ada pada penyelesaian contoh soal di bawah.
Soal:
Molaritas 4 gram NaOH yang dilarutkan dalam 2 liter air adalah …. (Ar Na = 23, O = 16, H = 1).
Jawab:
Mr NaOH = Ar Na + Ar O + Ar H = 23 + 16 + 1 = 40
Molaritas NaOH:
Contoh Soal dan Pembahasan
Latihan soal perhitungan kimia konsep mol ada di bawah.
Contoh 1
Volume gas NH3 yang massanya 3,4 gram bila diukur 27 oC dan 760 mmHg adalah …. (tetapan gas R = 0,082 L atm/ K mol)
A. 49,2 L
B. 24,6 L
C. 12,3 L
D. 4,92 L
E. 2,46 L
Pembahasan:
Dari soal diketahui beberapa informasi berikut.
Diketahui:
Massa NH3: Gr NH3 = 3,4 gram
Suhu:
T = 27 oC = (27 + 273) oK = 300 oK
Tekanan:
P = 760 mmHg = 1 atm
Tetapan gas: R = 0,082 L atm/ K mol
Mol NH3:
Menghitung volume NH3:
Jadi, volume gas NH3 yang massanya 4 gram bila diukur 27 oC dan 760 mmHg adalah 4,92 liter.
Jawaban: D
Contoh 2
Berapa molaritas larutan yang terjadi jika 4 gram NaOH dilarutkan ke dalam air sampai volume menjadi 500 mL?
A. 0,1 M
B. 0,2 M
C. 0,3 M
D. 0,4 M
E. 0,5 M
Pembahasan:
Dari soal diperoleh beberapa informasi berikut.
Diketahui:
Massa NaOH: Gr NaOH = 4 gram
Volume larutan: V = 500 mL
Rumus molaritas yang digunakan:
Mr NaOH = Ar Na + Ar O + Ar H = 23 + 16 + 1 = 40
Sehingga,
Jadi, molaritas larutan yang terjadi jika 4 gram NaOH dilarutkan ke dalam air sampai volume menjadi 500 mL adalah 0,2 M.
Jawaban: B
Sekian ulasan mengenai konsep mol pada perhitungan kimia. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Ikatan Kimia (Ion – Kovalen – Logam)
