Kapasitas kalor dan kalor jenis adalah dua jenis besaran yang berbeda, namun keduanya sama-sama disimbolkan dengan huruf f. Bedanya, kapasitas kalor disimbolkan dengan huruf c kapital/besar atau yang dituliskan C. Sementara kalor jenis disimbolkan dengan huruf c kecil atau yang dituliskan c. Penyimbolan yang berbeda tentunya berguna agar memudahkan dalam mengenali besaran.
Kalor sendiri dapat dipahami sebagai bentuk energi yang diberikan atau diterima suatu benda. Sifat kalor akan berpindah dari benda dengan suhu tinggi ke benda dengan suhu rendah. Satuan kalor dapat dinyatakan dalam kalori (cal) atau Joule (J), di mana 1 kalori = 4,18 joule dan 1 joule = 0,24 kalori.
Apa itu kapasitas kalor? Apa itu kalor jenis? Adakah hubungan antara kapasitas kalor dengan kalor jenis? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
Kalor Jenis (c)
Kalor jenis suatu zat adalah banyaknya kalor yang dibutuhkan/dilepaskan setiap kilogram massa untuk menaikkan/menurunkan satu derajad celcius atau kelvin. Kalor jenis berhubungan dengan kemampuan yang dimiliki setiap benda dalam menyerap kalor. Semakin besar kalor jenis suatu benda menunjukkan bahwa kemampuan menyerap kalor juga semakin besar.
Satuan kalor jenis dapat dinyaktakan dalam kal/groC atau J//groC, atau dapat juga dinyatakan dalam satuan kal/groC atau J/groK.
Secara matematis, persamaan kalor jenis sesuai dengan rumus berikut.

Baca Juga: 4 Rumus Usaha dalam Termodimika
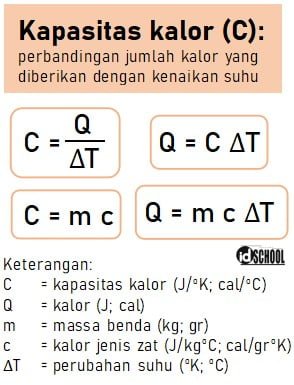
Kapasitas Kalor (C)
Kapasitas kalor adalah perbandingan antara jumlah kalor yang diberikan dengan kenaikan suhu suatu benda. Atau, kapasitas kalor dapat juga dipahami sebagai perbandingan kalor yang diberikan pada suatu zat dengan kenaikan suhu zat tersebut karena pemberian kalor.
Misalkan suatu zat diberikan kalor sejumlah 20 joule, setelahnya benda mengalami kenaikan suhu sebesar 2,5 oC. Maka dapat diketahui bahwa kapasitas kalor benda tersebut sama dengan C = 8 J/oC. Satuan kapasitas kalor dapat dinyatakan dalam J/oK atau J/oC, selain itu dapat juga dinyatakan dalam satuan cal/oK atau kal/oC.
Secara metematis, rumus kapasitas kalor sesuai dengan ketiga persamaan berikut.
Baca Juga: Rumus q reaksi dan Hubungannya dengan Perubahan Entalpi
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjana soal. Selamat Berlatih!
Contoh 1 – Kapasitas Kalor dan Kalor Jenis
Tembaga mula-mula suhunya 200 oC, kemudian didinginkan sampai 50 oC. Jika jumlah energi kalor yang dilepaskan 1.059 J maka kapasitas kalor tembaga adalah ….
A. 7,06 J/oC
B. 14,12 J/oC
C. 21,18 J/oC
D. 28,24 J/oC
E. 35,3 J/oC
Pembahasan:
Informasi pada soal memberikan beberapa keterangan besaran beserta nilainya seperti berikut.
- Suhu tembaga mula-mula: Tawal = 200 oC
- Suhu tembaga akhir: Takhir = 50 oC
- Perubahan suhu:
ΔT = Tawal ‒ Takhir
ΔT = 200 ‒ 50 = 150 oC - Jumlah energi kalor yang dilepaskan: Q = 1.059 J
Menentukan kapasitas kalor (C) tembaga:
C = Q/ΔT
C = 1.059/150 = 7,06 joule
Jadi, kapasitas kalor tembaga adalah 7,06 J/oC.
Jawaban: A
Baca Juga: Banyak/Jumlah Kalor yang Merambat/Berpindah pada Peristiwa Perpindahan Kalor
Contoh 2 – Kapasitas Kalor dan Kalor Jenis
Massa sebuah cincin perak sama dengan 5 gr dan suhunya 30 oC. Cincin tersebut dipanaskan dengan memberi kalor sejumlah 5 kal sehingga suhu cincin menjadi 47,5 oC. Kalor jenis cincin perak tersebut adalah ….
A. 0,057 kal/groC
B. 0,114 kal/groC
C. 0,570 kal/groC
D. 1,140 kal/groC
E. 5,700 kal/grsC
Pembahasan:
Informasi pada soal memberikan beberapa keterangan besaran beserta nilainya seperti berikut.
- Massa cincin perak = 5 gr
- Suhu awal cincin: Tawal = 30 oC
- Jumlah kalor yang ditambahkan: Q = 5 kal
- Suhu akhir cincin: Takhir = 47,5 oC
Menghitung kalor jenis cincin perak:
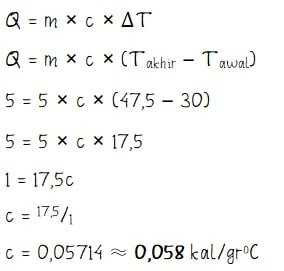
Jadi, kalor jenis cincin perak tersebut adalah 0,058 kal/groC.
Jawaban: A
Baca Juga: Rumus Kapasitas Kapasitor (C), Muatan (Q), dan Energi (W) yang Terimpan dalam Kapasitor
Contoh 3 – Hubungan Kapasitas Kalor (C) dan Kalor Jenis (c)
Dalam gelas berisi 200 cc air dengan suhu 40 oC, kemudian dimasukkan 40 gram es 0 oC. Jika kalor lebur es 80 kal/gram dan temperatur setimbangnya adalah 21,54 oC maka kapasitas kalor gelas adalah ….
A. 120 kal/oC
B. 60 kal/oC
C. 20 kal/oC
D. 12 kal/oC
E. 6 kal/oC
Pembahasan:
Berdasarkan informasi yang diberikan pada soal dapat diperoleh beberapa keterangan seperti berikut.
- Massa air dalam gelas: m = 200 cc
- Suhu air mula-mula: Tair = 40 oC
- Massa jenis air: cair = 1 kal/groC
- Massa es: 40 gram
- Suhu es: Tes = 0 oC
- Kalor lebur es: L = 80 kal/gram
- Temperatur setimbang sistem: Takhir = 21,54 oC
Penyelesaian persoalan seperti pada soal di atas menggunakan Azas Black melalui persamaan Qterima = Qlepas (kalor yang diterima sama dengan kalor yang dilepas).
Persamaan untuk kalor yang diterima:
Qterima = mair×cair×(Tair ‒ Takhir) + Cgelas×(Tair ‒ Takhir)
Qterima = 200 × 1 × (40 oC ‒ 21,54 oC) + Cgelas × (40 oC ‒ 21,54 oC)
Qterima = 200 × 1 × 18,46 + Cgelas × 18,46
Qterima = 3.692 kal + 18,46Cgelas
Persamaan untuk kalor yang dilepas:
Qlepas = mes × L + mes × cair × (Takhir ‒ Tes)
Qlepas = 40 × 80 + 40 × 1 × (21,54 ‒ 0)
Qlepas = 3.200 + 861,6 = 4.061,6 kal
Menghitung kapasitas kalor gelas:
Qterima = Qlepas
3.692 + 18,46Cgelas = 4.061,6
18,46Cgelas = 4.061,6 ‒ 3.692
18,46Cgelas = 369,6
Cgelas = 369,6/18,46
Cgelas = 20,021 ≈ 20 kal/oC
Jadi, kapasitas kalor gelas sama dengan Cgelas = 20 kal/oC.
Jawaban: C
Contoh 4 – Kapasitas Kalor dan Kalor Jenis

Pembahasan:
Bersadarkan informasi yang diberikan pada soal dapat diperoleh beberapa keterangan seperti berikut.
- Kalor jenis es: ces = 0,5 kal/groC
- Lalor lebur es: L 80 kal/gr
- Kalor jenis air: cair = 1 kal/groC
- Massa es: 500 gr
- Suhu es: Tes = ‒20 oC
- Suhu air: Tair = 20 oC
- Suhu akhir: T = 0 oC
Persamaan kalor yang diterima:
Qterima = mair × cair × (Tair ‒ T)
Qterima = mair × 1 × (20 ‒ 0)
Qterima = mair × 1 × 20 = 20mair
Persamaan kalor yang dilepas:
Qlepas = mes × L + mes × ces × (T ‒ Tes)
Qlepas = 500 × 80 + 500 × 0,5 × (0 ‒ (‒20))
Qlepas = 40.000 + 500 × 0,5 × 20
Qlepas = 40.000 + 5.000 = 45.000
Menghitung massa air mula-mula
Qterima = Qlepas
20mair = 45.000
mair = 45.000/20
mair = 2.250 gram = 2,25 kg
Jadi, massa air mula-mula adalah 2,25 kg.
Jawaban: C
Demikianlah tadi ulasan perbedaan dan hubungan kapasitas kalor (C) dengan kalor jenis (c). Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Hubungan Suhu dan Pemuaian
