Rumus usaha dalam termodinamikan dipengaruhi oleh besar kalor pada sistem dan jenis proses termodinamika apa yang terjadi. Sebuah sistem gas yang menyerap/melepaskan kalor sebesar Q maka oleh sistem akan mengubahnya menjadi usaha (W) dan energi dalam (ΔU). Perubahan yang terjadi dapat menjadi usaha luar dan energi dalam, energi dalam saja, atau usaha luar saja. Kondisi tersebut menekankan bahwa kalor yang dibutuhkan gas dalam sistem tidak hilang, tetapi mengalami perubahan bentuk.
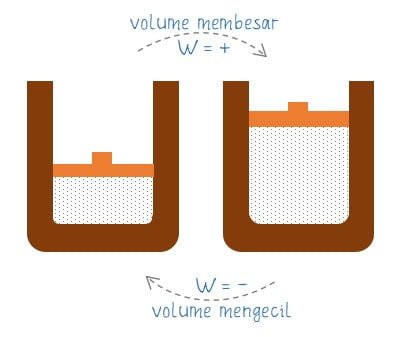
Bahasan mengenai perubahan kalor (Q) menjadi usaha luar (W), energi dalam (ΔU), atau keduanya dijelaskan melalui Hukum I Termodinamika. Hukum pertama termodinamika menyatakan hubungan kekekalan tenaga antara usaha yang dilakukan pada sistem, panas yang ditambahkan/dikurangkan, dan tenaga dalam sistem. Jika usaha dilakukan oleh sistem pada lingkungan membuat volume membesar karena gas mengembang maka usaha W bertanda positif (+). Jika usaha dilakukan pada sistem membuat volume mengecil karena berkurangnya volume gas maka usaha (W) pada sistem bertanda negatif (‒).
Baca Juga: Energi Kinetik Gas Ideal
Apa rumus kalor yang dibutuhkan gas? Bagaimana cara menghitung kalor yang dibutuhkan gas pada suatu sistem? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Rumus Usaha untuk 4 Proses Termodinamika
- Hubungan Rumus Usaha dalam Termodinamika dengan Kalor dan Energi Dalam Sesuai Hukum I Termodinamika
- Contoh Soal dan Pembahasan
Rumus Usaha untuk 4 Proses Termodinamika
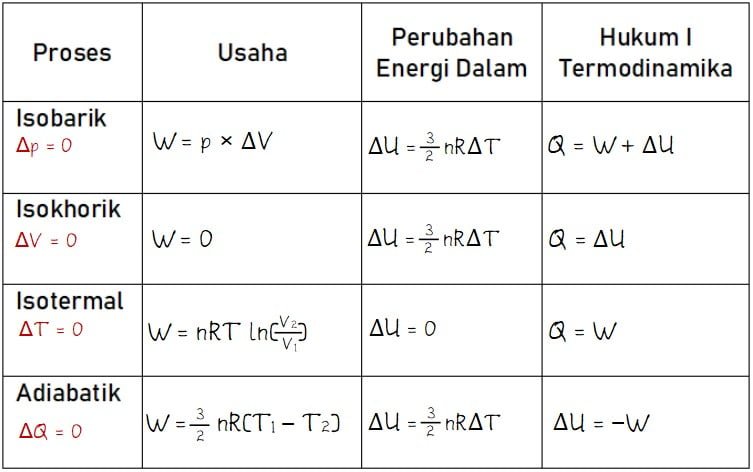
Gas dalam ruang tertutup dapat mengalami beberapa proses antara lain meliputi proses isobarik, isotermal, isokhorik, dan adiabatik. Besar usaha (W) untuk keempat proses termodinamika tersebut dapat dihitung dengan rumus usaha dalam termodinamika yang berbeda. Bahasan rumus usaha dalam termodinamika untuk empat macam proses diberikan seperti pada persamaan di bawah.
Rumus usaha isobarik
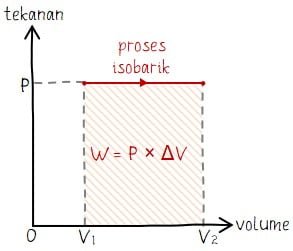
Isobarik adalah proses termodinamika yang berlangsung pada tekanan tetap sehingga perubahan tekanan sama dengan nol (ΔP = 0). Bentuk grafik proses isobarik pada grafik diagram P‒V berupa garis horizontal (mendatar). Besar usaha pada proses isobarik sama dengan luas daerah di bawah diagram P ‒ V yang secara umum dapat dinyatakan dengan W = p × ΔV. Di mana, W adalah besar usaha yang dilakukan, p adalah tekanan, dan ΔV adalah besar perubahan volume.
Rumus usaha isokhorik
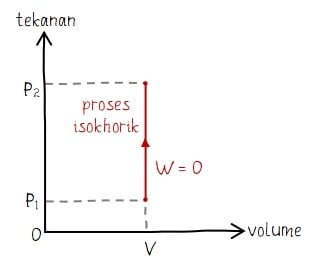
Isokhorik dalah proses termodinamika yang terjadi pada kondisi gas tidak mengalami perubahan volume (ΔV = 0). Sehingga, besar usaha yang dilakukan pada proses isokhorik adalah W = P × ΔV = P × 0 = 0. Bentuk grafik diagram P V untuk proses isokhorik berupa garis vertikal. Gambar grafik tidak memiliki, hal ini sesuai dengan persamaan di mana nilai W = 0.
Rumus usaha isotermik
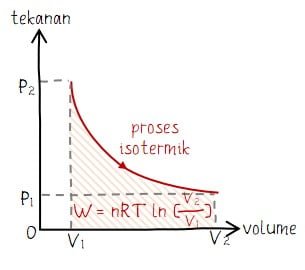
Isotermik adalah proses dalam termodinamika di mana gas tidak mengalami perubahan suhu (suhu tetap/konstan). Bentuk grafik diagram P V pada proses isotermik berupa kurva lengkung yang luas di bawahnya dapat dicari dengan integral. Dengan membawa persamaan umum, rumus usaha dalam termodinamika untuk proses isotermik dapat dihitung melalui persamaan berikut.
Rumus usaha adiabatik
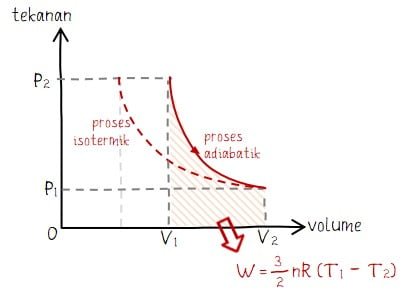
Adiabatik adalah proses termodinamika yang terjadi pada lingkungan tertutup sehingga tidak terjadi pertukaran kalor dari/ke sistem. Tidak adanya pertukaran kalor membuat nilai perubahan kalor sama dengan nol atau Q = 0. Bentuk grafil diagram P V pada proses adiabatik terlihat seperti grafik pada proses isotermik.
Perbedaan antara adiabatik dan isotermik terdapat pada ada tidaknya pengaruh lingkungan kepada sistem. Sistem pada proses adiabatik tidak mendapat pengaruh dari lingkungan, sedangkan sistem pada proses isotermik mendapat pengaruhi dari lingkungan.
Cara mendapatkan rumus usaha adiabatik hampir sama dengan proses isotermik. Perbedaannya terletak pada penggunaan rumus umum tekanan. Di mana, rumus usaha adiabatik dapat dihtiung melalui persamaan berikut.
Ringkasan Rumus Usaha Isobarik, Isokhorik, Isotermik, dan Adiabatik
Tabel rumus usaha dalam termodinamika dan besar perubahan energi dalam untuk setiap proses termodinamikan sesuai dengan persamaan berikut.
Baca Juga: Besar Usaha dan Efisiensi Mesin Carnot
Hubungan Rumus Usaha dalam Termodinamika dengan Kalor dan Energi Dalam Sesuai Hukum I Termodinamika
Salah satu contoh hukum kekekalan energi di mana energi tidak dapat diciptakan dan tidak dapat dimusnahkan terdapat pada Hukum I Termodinamika. Meskipun tidak dapat diciptakan dan dimusnahkan namun energi dapat berubah dari satu bentuk energi ke bentuk energi lain.
Hukum I Termodinamika menyatakan bahwa untuk setiap kalor (Q) yang diberikan kepada sistem dan sistem melakukan usaha (W) maka akan terjadi perubahan energi dalam (ΔU).
Satuan kalor, energi dalam, dan usaha dapat dinyakatakan dalam Pa∙m3 = Joule (J) atau kalori (kal). Antara satuan joule dan kalori memiliki persamaan untuk 1 kalori = 4,2 joule.
Baca Juga: Persamaan Umum Gas Ideal
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan rumus usaha dalam termodinamika yang meliputi proses isobarik, isokhorik, isotermik, dan adiabatik. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan bagaimana penggunaan rumus usaha dalam termodinamika. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Rumus Usaha Dalam Termodinamika
Suatu sistem melepaskan panas 200 kalori tanpa melakukan usaha luar, maka perubahan energi dalam sistem tersebut sebesar ….
A. –840 J
B. –480 J
C. –48 J
D. 47,6 J
E. 470 J
Pembahasan:
Dari keterangan yang diberikan pada soal dapat diperoleh informasi seperti berikut.
- Kalor yang dilepaskan: Q = ‒200 kalori
(tanda negatif menunjukkan sistem melepaskan kalor) - Usaha luas yang dilakukan: W = 0
Menghitung perubahan energi:
Q = ΔU + W
‒200 = ΔU + 0
ΔU = ‒200 kalori
Mengubah satuan kalori ke joule:
ΔU = ‒200 kalori
ΔU = ‒200 × 4,2 joule
ΔU = ‒840 joule
Jadi, perubahan energi dalam sistem tersebut sebesar –840 J.
Jawaban: A
Contoh 2 – Penggunaan Rumus Usaham dalam Termodinamika
Perhatikan diagram P‒V berikut!

Usaha yang dilakukan sistem selama 1 siklus ABCDA adalah …
A. 200 kJ
B. 300 kJ
C. 400 kJ
D. 500 kJ
E. 600 kJ
Pembahasan:
Besar usaha pada suatu diagram P‒V dapat dihitung melalui luas bangun yang dibentuk oleh diagram. Diketahui bahwa 1 siklus ABCDA pada sistem tersebut membentuk bangun persegi panjang dengan panjang p = AD = BC = 6 ‒ 3 = 3 × 105 Pa dan lebar ℓ = AB = DC = 3 ‒ 1 = 2 m3. Sehingga, usaha yang dilakukan selama 1 siklus ABCDA dapat dihitung seperti cara berikut.
Menghitung usaha:
W = Luas persegi panjang ABCD
W = panjang (p) × lebar (ℓ)
W = AD × AB
W = (3 × 105) × 2
W = 6 × 105 Pa∙m3 = 600.000 Joule = 600 kJ
Jawaban: D
Contoh 3 – Rumus Usaha dalam Termodinamika
Untuk gas ideal yang menjalani proses isotermal, jika Q = kalor, ΔU = perubahan energi dalam dan W = usaha maka:
A. Q = W
B. Q > w
C. C < W
D. Q = ΔU
E. W = ΔU
Pembahasan:
Pada proses isotermal terjadi pada kondisi suhu konstan sehingga maka ΔU = 0. Berdasarkan Hukum I Termodinamika memenuhi persamaan Q = ΔU + W, sehingga Q = 0 + W = W.
Jadi, untuk gas ideal yang menjalani proses isotermal, jika Q = kalor, ΔU = perubahan energi dalam dan W = usaha maka Q = W.
Jawaban: A
Demikianlah tadi ulasan rumus usaha dalam termodinamika. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Cara Menghitung Perubahan Entalpi pada Suatu Reaksi Kimia