Larutan Elektrolit dan Non Elektrolit merupakan larutan yang dapat menghantarkan listrik dan lautan yang tidak dapat menghantarkan listrik. Sebelum membahas lebih lanjut larutan elektrolit dan non elektrolit, ingat kembali apa itu larutan? Larutan adalah campuran homogen dua zat atau lebih yang saling melarutkan dan masing – masing zat penyusunnya tidak dapat dibedakan lagi secara fisis. Larutan terdiri dari dua komponen yakni zat terlarut dan zat pelarut. Contoh pada larutan garam terdiri dari garam sebagai zat pelarut dan air sebagai zat pelarut. Lalu bagaimana dengan penjelasan untuk larutan elektrolit dan non elektrolit? Sobat idschool dapat menyimaknya melalui halaman ini.
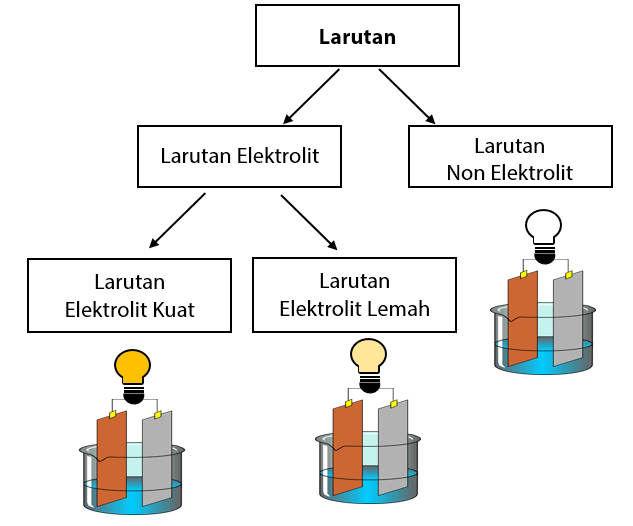
Berdasarkan daya hantar listriknya, larutan dibedakan menjadi dua macam, yakni larutan elektrolit dan larutan non elektrolit. Karakteristik dari larutan elektrolit adalah mampu menghantarkan listrik. Sedangkan larutan non elektrolit tidak mampu menghantarkan listrik. Untuk larutan elektrolit dibedakan lagi menjadi larutan elektrolit kuat dan elektrolit lemah.
Baca Juga: Macam – Macam Ikatan Kovalen
Bagaimana larutan elektrolit bisa menghantarkan listrik sedangkan larutan non elektrolit tidak dapat menghantarkan listrik? Simak lebih lanjut pembahasannya pada masing – masing bahasan berikut.
Table of Contents
Larutan Elektrolit
Pengertian dari elektrolit sendiri adalah suatu zat yang ketika dilarutkan dalam air akan menghasilkan larutan yang dapat menghantarkan arus listrik. Sehingga, pengertian dari larutan elektrolit adalah larutan yang dapat menghantarkan arus listrik.
Larutan elektrolit dapat menghantarkan listrik karena pada larutan terdapat ion-ion yang bergerak bebas. Keberadaan ion – ion dalam larutan tersebutlah yang berperan untuk menghantarkan listrik. Larutan elektrolit biasanya terdapat pada senyawa ionik dan kovalen polar.
Ada 2 jenis larutan elektrolit yaitu larutan elektrolit kuat dan larutan elektrolit lemah.

1) Larutan elektrolit kuat:
larutan yang memiliki daya hantar listrik besar. Jenis larutan yang termasuk dalam larutan elektrolit kuat terionisasi sempurna di dalam air. Jika diuji dalam penguji elektrolit sederhana, lampu akan menyala terang dan akan banyak terdapat gelembung gas pada plat. Contoh larutan elektrolit kuat antara lain larutan NaCl, KOH, H2SO4, dan HCl.
2) Larutan elektrolit lemah:
larutan yang memiliki daya hantar kecil karena tidak semua zat terionisasi, atau hanya mengalami ionisasi sebagian. Jika diuji dengan penguji elektrolit sederhana, lampu akan menyala redup dan pada plat logam hanya terdapat sedikit gelembung gas. Contoh larutan elektrolit lemah adalah larutan cuka (CH3COOH) dan amonia (NH3 ).
Larutan elektrolit dimanfaatkan untuk beberapa kegiatan yang bermanfaat seperti baterai, cairan isotonik, aki kendaraan, oralit, dan pembersih rumah tangga (natrium hidroksida).
Larutan Non Elektrolit
Arti dari kata non elektrolit adalah tidak menghantarkan arus listrik ketika dilarutkan ke dalam air. Jadi dapat dikatakan bahwa larutan non elektrolit adalah larutan yang tidak dapat menghantarkan listrik. Larutan non elektrolit tidak akan terionisasi dalam larutan sehingga tidak ada yang berperan sebagai penghantar listrik.

Jenis larutan non elektrolit biasanya terdapat pada senyawa kovalen non polar. Larutan non elektrolit dalam kehidupan sehari – hari dapat dijumpai seperti pada air suling, urea, gula, dan alkohol.
Baca Juga: Praktikum Kimia – Uji Larutan Elektrolit dan Non Elektrolit
Perbedaan Larutan Elektrolit dan Non Elektrolit
Untuk membedakan larutan elektrolit dan nonelektrolit, dapat menggunakan derajat disosiasi (α). Derajat disosiasi adalah fraksi molekul yang benar – benar terdisosiasi. Atau dapat juga merupakan perbandingan mol zat terionisasi dengan mol zat mula-mula. Penentuan nilai derajat disosiasi merupakan perbandingan antara mol zat terionisasi dan mol zat mula – mula. Nilai derajat disosiasi (α) dapat dicari melalui rumus derajat disosiasi (α).
Rumus Derajat Disosiasi (α):

Nilai α dapat berubah – ubah antara rentang 0 – 1, kriteria derajat disosiasi (α) memenuhi ketentuan berikut.
- α = 1 → larutan terdisosiasi sempurna (elektrolit kuat)
- 0 < α < 1 → larutan terdisosiasi sebagian (elektrolit lemah)
- α = 0 → larutan tidak terdisosiasi (non elektrolit)
Baca Juga: Perhitungan Kimia – Konsep Mol
Kesimpulan perbedaan antara larutan elektrolit dan non elektrolit dapat dilihat berdasarkan daya hantar listrik, uji nyala lampu, uji gelembung gas pada elektroda, ionisasi dalam air, dan jenis ikatan kimia yang terbentuk. Perbedaan larutan elektrolit dan non elektrolit dapat dilihat pada tabel berikut.

Sekian ulasan materi larutan elektrolit dan non elektrolit juga perbedaan larutan elektrolit dan non elektrolit. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Ikatan Kimia – Ion, Kovalen, Logam
