Perubahan entalpi standar yang menyertai suatu reaksi dinyatakan dengan notasi ΔH (dibaca: delta H). Istilah entalpi (H) digunakan untuk menyebut total energi dalam pada bahasan termodinamika. Energi dalam (E) adalah total energi yang dimiliki oleh suatu benda. Bentuk energi dapat berupa panas/kalor (termal), gerak/mekanik, bunyi, listrik, magnet, cahaya, dan kimia. Namun dalam bahasan termodinamika, bentuk energi yang berkaitan adalah energi panas.
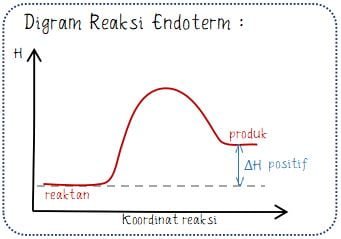
Perubahan entalpi (ΔH) menunjukkan selisih antara entalpi sistem sebelum reaksi dan setelah reaksi berlangsung. Pada reaksi eksoterm, sistem memiliki entalpi yang lebih rendah pada akhir reaksi (Hakhir < Hawal dan ΔH negatif). Sedangkan pada reaksi endoterm, sistem memiliki entalpi yang lebih besar pada akhir reaksi (Hakhir > Hawal dan ΔH positif).


Beberapa macam perubahan entalpi standar yang meliputi pembentukan (ΔHfo), penguraian (ΔHdo), pembakaran (ΔHco), netralisasi (ΔHn), penguapan (Hvo), dan pencairan (ΔHlo).
Keenam macam perubahan entalpi standar tersebut berdasarkan macam reaksi atau perubahan kimia yang terjadi. Penjelasan untuk setiap macam-macam perubahan entalpi standar diberikan seperti penjelasan berikut.
Baca Juga: Cara Menghitung Laju Reaksi dan Faktor-Faktor yang Mempengaruhinya
1. Perubahan Entalpi Standar Pembentukan (ΔHf°)
Perubahan entalpi standar pembentukan adalah perubahan jumlah energi standar yang terdapat pada pembentukan 1 mol senyawa dari unsur-unsurnya. Simbol untuk perubahan entalpi standar pembentukan dinyatakan dengan ΔHf°. Keterangan indeks f berasal dari kata formation yang berarti pembentukan.
Besar nilai ΔHf° digunakan untuk senyawa, sedangkan harga ΔHf° untuk unsur-unsur bebas adalah nol.
Misalnya pada pembentukan satu molekul H2O cari dari satu molekul gas H2 dan setengah molekul gas O2 melepaskan kalor sebanyak 285,9 kJ/mol. Persamaan reaksi yang sesuai untuk pembentukan satu molekul H2O cair adalah sebagai berikut.
H2 (g) + 1/2O2 (g) → H2O (l) ΔHf° = –285,9 kJ
ΔHf adalah perubahan kalor yang dilepaskan atau yang diserap oleh sistem pada reaksi pembentukan 1 mol senyawa dari unsur-unsurnya. Keterangan tanda negatif (–) di depan nilai ΔH menunjukkan bahwa reaksi melepaskan kalor/energi. Sedangkan pada reaksi yang menyerap kalor diberi keterangan tanda positif (+).
2. Perubahan Entalpi Standar Penguraian (ΔHd°)
Perubahan entalpi standar penguraian adalah perubahan jumlah energi standar pada penguraian 1 mol senyawa menjadi unsur-unsurnya. Huruf indeks d berasal dari kata decompotition yang berarti penguraian.
Berdasarkan rumusan Marquis de Laplace, jumlah kalor yang dilepaskan pada pembentukan senyawa dari unsur-unsurnya sama dengan jumlah kalor yang diperlukan pada penguraian senyawa tersebut menjadi unsur-unsurnya. Atau dapat disimpulkan bahwa ΔHd° merupakan kebalikan dari ΔHf° dan besar nilainya juga merupakan kebalikannya.
Bahasan sebelumnya terdapat keterangan pembentukan satu molekul H2O cair dari gas H2 dan O2 melepaskan kalor sebanyak 285,9 kJ/mol. Sehingga, pada penguraian satu moleuk gas H2O cair membutuhkan atau menyerap kalor sebanyak 2,85 kJ/mol.
Persamaan reaksi yang sesuai untuk penguraian satu molekul H2O cair menjadi unsur-unsurnya adalah:
H2O (l) → H2 (g) + 1/2O2 (g) ΔHd° = –285,9 kJ
Baca Juga: Cara Pengenceran dan Pemekatan Larutan
3. Perubahan Entalpi Standar Pembakaran (ΔHc°)
ΔHc° adalah simbol untuk perubahan entalpi standar pembakaran. Di mana huruf indeks c berasal dari kata combution yang artinya pembakaran. Sehingga ΔHc dapat dipahami sebagai perubahan jumlah energi pada pembakaran 1 mol suatu zat yang pengalami pembakaran sempurna pada kondisi standar.
Entalpi pembakaran merupakan kalor yang dilepaskan oleh sistem pada reaksi pembakaran 1 mol unsur/senyawa. Semua reaksi menghasilkan atau melepaskan kalor sehingga reaksi pembakaran termasuk dalam reaksi eksoterm. Reaksi pembakaran ditandai dengan terlibatnya gas O2 pada pereaksi.
Sebagai contoh, pada pembakaran 1 mol glukosa (C6H12O6) melepaskan 2.803 kJ/mol. Persamaan termokimia yang sesuai pada pembakaran glukosa tersebut adalah sebagai berikut.
C6H12O6 (s) + 6O2 (g) → 6CO2 + 6H2O (g) ΔHco = –2.803 kJ
4. Entalpi standar netralisasi (ΔHn)
Perubahan entalpi standar netralisasi adalah perubahan jumlah energi standar pada penetralan 1 mol asam (H+) oleh basa (OH–). Perubahan entalpi standar netralisasi dinyatakan dengan notasi ΔHn. Indeks n yang menyertai keterangan ΔH berasal dari kata netrallization (penetralan).
Nilai entalpi penetralan menunjuk pada besar energi/kalor yang dilepaskan oleh sistem pada reaksi penetralan. Jenis reaksi pada reaksi netralisasi selalu eksoterm karena terjadi pelepasan kalor.
Hasil reaksi atau produk pada reaksi penetralan salah satunya adalah air (H2O) sebagai mana hasil reaksi dari OH– + H+ → H2O. Sebagai contoh pada reaksi NaOH (basa) dan HCl (asam) menghasilkan NaCl dan H2O dengan melepaskan kalor sebanyak 57,7 kJ.
NaOH (s) + HCl (aq) → NaCl (aq) + H2O (l) ΔHno = –57,7 kJ
5. Entalpi Standar Penguapan (ΔHvo) dan Pencairan (ΔHlo)
ΔHv adalah simbol untuk perubahan entalpi standar penguapan, sedangkan ΔHl adalah seimbol untuk perubahan entalpi pencairan. Entalpi standar penguapan/pencairan menunjuk pada benyak kalor/energi yang dibutuhkan pada suatu reaksi.
Baik penguapan atau pencairan merupakan reaksi yang membutuhkan atau menyerap kalor. Sehingga kedua reaksi tersebut termasuk dalam reaksi endoterm.
Perubahan entalpi standar penguapan (ΔHv) adalah perubahan jumlah energi standar reaksi pada penguapan 1 mol zat dalam fase cair menjadi zat dalam fase gas pada titik didihnya. Misalnya pada proses reaksi H2O cair (fase liquid) menjadi H2O dalam bentuk uap air (fase gas) yang membutuhkan kalor sebanyak 44 kJ.
Contoh: H2O (l) → H2O (g) ΔHvo = +44 kJ
Perubahan entalpi standar penguapan (ΔHl) adalah perubahan jumlah energi standar reaksi pada pencairan 1 mol zat dalam fase padat menjadi zat dalam fase cair pada titik leburnya. Misalnya pada proses reaksi H2O es/padat (fase solid) menjadi H2O cair (fase liquid) yang membutuhkan kalor sebanyak 36,4 kJ.
Contoh: H2O (s) → H2O (l) ΔHlo = +36,4 kJ
Demikianlah tadi ulasan macam-macam perubahan entalpi standar yang meliputi entalpi pembentukan (ΔHf) , penguraian (ΔHd) , pembakaran (ΔHc) , penetralan (ΔHn) , dan penguapan (ΔHv) serta pencairan (ΔHl) . Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Kelarutan (s) dan Hasil Kali Kelarutan (Ksp)
