Kelarutan (s) dan hasil kali kelarutan (Ksp) adalah bahasan mengenai kemampuan garam-garam dapat larut dalam air. Di mana terdapat perbedaan kemampuan suatu garam untuk larut. Ada garam yang mudah larut dalam air seperti NaCl (natrium klorida). Ada garam yang sukar larut dalam air seperti AgCl (perak klorida).
Faktor yang menyebabkan suatu zat dapat terlarut atau tidak dalam air dalah kepolaran dan ikatan hidrogen. Air merupakan pelarut polar sehingga dapat melarutkan zat yang juga bersifat polar. Air dapat melarutkan zat-zat yang dapat membentuk ikatan hidrogen dalam air.
Beberapa zat dalam kehidupan sehari-hari ada yang mudah larut dalam air seperti gula, garam, dan vetsin. Beberapa zat yang tidak larut dalam air adalah kloroform (CHCl3), benzena (C6H6), dan heksana (C6H14).
Bagaimana hubungan dari kelarutan dan hasil kali kelarutan? Sobat idschool dapat mencari tahu jawabanya melalui ulasan di bawah.
Daftar isi:
Baca Juga: Senyawa Hidrokarbon (Alkana, Alkena, dan Alkuna)
Kelarutan (s)
Kelarutan adalah jumlah maksimum garam sebagai zat terlarut yang dapat dilarutkan ke dalam air disebut kelarutan. Nilai kelarutan menunjukkan konsentrasi zat terlarut dalam suatu larutan. Misalnya, diketahui kelarutan AgCl sama dengan 1,25 × 10‒5 mol per liter. Artinya, jumlah maksimum AgCl yang dapat larut dalam 1 liter air (larutan) adalah 1,25 × 10‒5 mol.
Kelarutan dinyatakan dalam simbol huruf s (solubility). Satuan kelarutan adalah molaritas (M). Sedangkan satuan zat terlarut yang dapat dilarutkan dalam air adalah molalitas (m).
Semakin besar nilai kelarutan (s), zat terlarut akan mudah larut atau sulit mengendap. Sebaliknya, semakin kecil nilai kelarutan (s) zat terlarut artinya zat terlarut sukar larut atau mudah mengendap.
Ada beberapa persamaan yang dapat digunakan untuk menghitung besar kelarutan. Penggunaan persamaan didasarkan pada informasi yang diketahui atau diberikan pada soal.
Rumus untuk menghitung besar kelarutan terdapat pada persamaan-persamaan berikut.
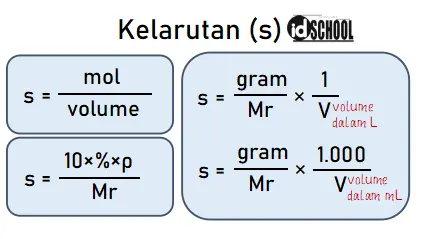
- Keterangan:
- s = kelarutan
- ρ = massa jenis larutan
- % = persentase atau kadar larutan
- Mr = massa molekul larutan
- gram = massa zat terlarut
- V = volume
Baca Juga: Reaski Redoks (Reduksi-Oksidasi)
Hasil Kali Kelarutan (Ksp)
Hasil kali kelarutan (Ksp) adalah hasil kali konsentrasi ion-ion pangkat koefisien larutan (hubungan kuantitatif antara zat terlarut dan pelarut). Panjang koefisien larutan diperoleh dari reaksi kesetimbangan.
Garam-garam yang sukar larut seperti AgCl dan BaSO4 jika dimasukkan dalam air murni lalu diaduk akan terlarut. Meskipun banyak zat terlarut dari bagian garam-garam tersebut hanya sedikit sekali. Mengapa? Karena garam-garam tersebut merupakan elektrolit, garam yang terlarut akan terionisasi sehingga dalam larutan akan terbentuk suatu kesetimbangan.
Ada hubungan antara kesetimbangan reaksi dengan rumus hasil kali kelarutan. Secara umum, cara mendapatakan Ksp pada garam diperoleh seperti bentuk berikut.

Contoh mendapatkan persamaan hasil kali kelipatan untuk beberapa garam diberikan seperti berikut.
- AgCl (s) ⇄ Ag+ (aq) + Cl‒ (aq)
Ksp AgCl = [Ag+][Cl‒]
- Ag2SO4 (s) ⇄ 2Ag+ (aq) + SO42‒ (aq)
Ksp Ag2SO4 = [Ag+]2[SO42‒]
- Al(OH)3 (s) ⇄ Al3+ (aq) + 3OH‒ (aq)
Ksp Al(OH)3 = [Al3+][OH‒]3
Baca Juga: Larutan Elektrolit dan Non Elektrolit
Hubungan Nilai Qc dan Ksp
Nilai Ksp menunjukkan suatu kondisi tidak terjadi perubahan jumlah padatan terlarut yang ditandai dengan laju disolusi = laju presipitasi. Disolusi adalah proses suatu zat solid memasuki pelarut untuk menghasilkan suatu larutan. Presipitasi adalah proses keluarnya suatu senyawa dari larutan.
Nilai Qc adalah nilai hasil kali kelarutan pada keadaan yang belum bisa dipastikan apakah larutan tersebut belum jenuh, tepat jenuh, atau lewat jenuh (hasil kali konsentrasi ion sementara). Perbandingan nilai Ksp dan Qc dapat digunakan untuk mengetahui apakah terdapat endapan zat terlarut dalam suatu larutan.
- Reaksi Pengendapan:
- Qc < ksp : larutan belum jenuh → tidak terdapat endapan
- Qc = ksp : larutan tepat jenuh → mulai akan mengendap
- Qc>ksp : larutan lewat jenuh → terjadi pengendapan
Sebagai contoh perhatikan kondisi seperti soal di bawah.
Soal:
Sebanyak 10 mL larutan CaCl2 0,2 M dicampurkan dengan 10 mL larutan NaOH 0,02 M. Jika diketahui Ksp Ca(OH)2 = 8 × 10‒6 maka selidikilah apakah terjadi endapan?
Penyelesaian:
Menghitng kelarutan [Ca2+] dan [OH‒]:

Menghitung Qc untuk Ca(OH)2:
Qc = [Ca2+][OH‒]2 = 10‒1 × (10‒2)2
Qc = 10‒1 × 10‒4 = 10‒5
Diperoleh hasil Qc = 10‒5 dan diketahui Ksp Ca(OH)2 = 8 × 10‒6, sehingga dapat disimpulkan bahwa Qc > Ksp. Saat nilai Qc > Ksp terjadi pengendapan. Jadi, pada pelarutan 10 mL larutan CaCl2 0,2 M dicampurkan dengan 10 mL larutan NaOH 0,02 M akan terjadi pengendapan.
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap soal yang diberikan dilengkapi degan pembahasannya.
Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Kelarutan CaF2 pada suhu tertentu dalam air murni adalah 0,02 mol/L …
Kelarutan CaF2 pada suhu tertentu dalam air murni adalah 0,02 mol/L. Hasil kali kelarutan garam tersebut adalah ….
A. 3,2 × 10‒4
B. 4 × 10‒4
C. 8 × 10‒4
D. 3,2 × 10‒5
E. 6,4 × 10‒5
Pembahasan:
Berdasarkan informasi yang diberikan pada soal dapat diperoleh keterangan-keterangan seperti berikut.
- Garam CaF2
- Kelarutan CaF2: s = 0,02 mol/L = 0,02 M
Menentukan rumus dan nilai Ksp dari garam BaF2:

Jadi, hasil kali kelarutan garam tersebut adalah 3,2 × 10‒5.
Jawaban: D
Baca Juga: Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekuk Relatif (Mr)
Contoh 2 – Apabila hasil kali kelarutan Pb(OH)2 = 4,0 × 10‒15 maka kelarutan senyawa itu adalah ….
Apabila hasil kali kelarutan Pb(OH)2 = 4,0 × 10‒15 maka kelarutan senyawa itu adalah ….
A. 1,0 × 10‒5 mol/L
B. 2,0 × 10‒5 mol/L
C. 3,2 × 10‒5 mol/L
D. 4,0 × 10‒8 mol/L
E. 4,8 × 10‒8 mol/L
Pembahasan:
Kesetimbangan reaksi ion: Pb(OH)2 ⇄ Pb2+ + 2OH‒ sehingga Ksp Pb(OH)2 = [Pb2+][OH‒]2 = [s][2s]2 = 4s3.
Ksp Pb(OH)2 = 4 × 10‒15
4s3 = 4 × 10‒15
s = 10‒15/3 = 10‒5
Jadi, kelarutan senyawa itu adalah 1,0 × 10‒5 mol/L.
Jawaban: A
Contoh 3 – Penelitian terhadap suatu sumber air yang melalui pipa besi …
Penelitian terhadap suatu sumber air yang melalui pipa besi menunjukkan bahwa setiap 10 liter air terlarur 18 mg Fe(OH)2. Diketahui Ar Fe = 56, O = 16, dan H = 1 maka hasil kali kelarutan Fe(OH)2 adalah ….
A. 3,2 × 10‒5
B. 4,0 × 10‒10
C. 3,2 × 10‒12
D. 4,0 × 10‒13
E. 3,2 × 10‒14
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Volume: v = 10 ℓ = 10.000 mℓ
- Massa: gr = 18 mg = 1,8 × 10‒2 gram
- Mr Fe(OH)2 = Ar Fe + 2 × Ar O + 2 × Ar H
= 56 + 2 × 16 + 2 × 1
= 56 + 32 + 2 = 90
Menghitung nilai kelarutan (s) Fe(OH)2:
Menentukan kesetimbangan reaksi ion Fe(OH)2:
Fe(OH)2 (s) ⇄Fe2+ (aq) + 2OH‒ (aq)
Hasil kali kelarutan Fe(OH)2:
Ksp Fe(OH)2 = [Fe2+][OH‒]2
Ksp Fe(OH)2 = s × (2s)2 = s × 4s2 = 4s3
Substitusi nilai s = 2 × 10-5 pada persamaan Ksp Fe(OH)2:
Ksp Fe(OH)2 = 4s3 = 4 × (2 × 10-5)3
Ksp Fe(OH)2 = 4 × 8 × 10-15 = 3,2 × 10-14
Jadi, hasil kali kelarutan Fe(OH)2 adalah 3,2 × 10‒14 M3.
Jawaban: E
Demikianlah tadi ulasan kelartuan (s) dan hasil kali kelarutan (Ksp). Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Hukum Perbandingan Volume (Hukum Gay Lussac)
