Beberapa reaksi kimia dapat berlangsung dengan dua arah atau bolak-balik. Pada reaksi dua arah, saat zat-zat hasil reaksi bereaksi kembali membentuk zat-zat semula (pereaksi). Reaksi bolak-balik berlangsung sampai saat laju reaksi ke kanan sama dengan laju reaksi ke kiri. Suatu kondisi pada reaksi bolak-balik yang telah mencapai keadaan setimbang disebut dengan kesetimbangan kimia.
Persamaan reaksi yang berlangsung dua arah dikenali melalui penggunaan dua anak panah dengan arah berbeda ( ⇄). Reaksi yang berjaalan dua arah dikenal dengan istilah reaksi reversible. Contoh reaksi reversible terdapat pada reaksi pembuatan gas amonia (NH3). Setiap NH3 yang terbentuk pada reaksi pembuatan gas amonia akan segera terurai lagi menjadi gas H2 dan gas N2.

Baca Juga: Laju Reaksi dan Cara Menentukan Orde Reaksi
Jika suatu reaksi kimia sudah mencapai kesetimbangan maka konsentrasi reaktan dan produk menjadi konstan. Kondisi zat-zat pereaksi (reaktan) dan produk (hasil reaksi) pada kesetimbangan kimia sama-sama berbentuk campuran.
Hukum Kesetimbangan Kimia
Pada awalnya, reaksi kimia dua arah berlangsung ke arah pembentukan hasil reaksi. Namun sesaat kemudian arah reaksi menjadi berlangsung ke kiri atau ke arah pembentukan zat-zat semula. Kesetimbangan kimia kemudian akan tercapai bila kecepatan reaksi ke kanan sama dengan kecepatan reaksi ke kiri. Selain itu, konsentrasi reaktan dan produk tidak berubah-ubah lagi (konstan) saat mencapai kesetimbangan.
Dalam kesetimbangan kimia terdapat hubungan antara kesetimbangan dengan persamaan reaksi yang disebut hukum kesetimbangan.
Bunyi hukum kesetimbangan:
Hasil kali kosentrasi produk (kanan) dipangkatkan koefisien reaksinya dibagi dengan hasil kali konsentrasi reaktan (kiri) dipangkatkan koefisien reaksinya mempunyai nilai yang sama pada suhu tertentu.
Dari hukum kesetimbangan menyatakan bahwa hasil kali konsentrasi zat-zat hasil reaksi (dipangkatkan koefisien) dibagi dengan hasil kali konsentrasi zat-zat pereaksi (dipangkatkan koefisien) mempunyai suatu nilai yang tetap.
Berdasar keadaan zat atau tingkat wujud zat yang turut dalam reaksi setimbang dibedakan menjadi dua. Kedua macam reaksi meliputi reaksi kesetimbangan homogen dan heterogen. Contoh reaksi kesetimbangan homogen adalah H2 (g) + I2 (g) ⇄2 HI (g). Sedangkan contoh reaksi kesetimbangan heterogen adalah C (s) + O2 (g) ⇄CO2 (g).
Perhatikan pada contoh reaksi kesetimbangan homogen memiliki fase zat yang semuanya berupa gas (g). Sedangkan pada contoh reaksi kesetimbangan heterogen terdapat fase zat yang solid (s) dan gas (g).

Kesimpulannya, jika semua fase pada persamaan reaksi adalah sama maka merupakan reaksi kesetimbangan homogen. Sedangkan jika persamaan reaksi memiliki fase yang berbeda maka merupakan reaksi kesetimbangan heterogen.
Baca Juga: Rumus Tetapan Kesetimbangan Kc dan Kp
Persamaan Tetapan Kesetimbangan (K) Kimia
Konstanta konsentrasi secara umum pada reaksi kesetimbangan pada reaksi m A (g) + n B (g) ⇄ p C (g) + q D (g) memenuhi persamaan di bawah.
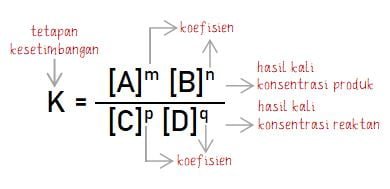
Konsentrasi zat yang memengaruhi laju reaksi hanya dari zat-zat yang homogen (gas atau larutan). Sehingga, konsentrasi zat yang berpengaruh atau disertakan dalam rumus tetapan kesetimbangan hanya zat-zat dengan fase gas (g) atau larutan (aq). Fase solid (s) dan liquid (l) tidak mempengaruhi kesetimbangan kimia.
Padatan (s) dan cairan murni (l) tidak mempengaruhi kesetimbangan. Hal ini dikarenakan padatan dan cairan murni tidak berubah meskipun terdapat perubahan volume atau suhu pada kesetimbangan konsnetrasi.
Sebagai contoh, tuliskan rumus hukum kesetimbangan (K) untuk reaksi berikut!
1) H2 (g) + I2 (g) ⇄2 HI (g)
2) Cu2+ (aq) + Zn (s) ⇄Zn2+ (aq) + Cu (s)
3) NH3 (g) + CO2 (g) ⇄ NH2CO2NH4 (s)
Penyelesaian:
Pada reaksi nomor 1) semua fase zat adalah gas (g), sehingga semua konsentrasi mempengaruhi nilai tetapan kesetimbangan. Tetapan kesetimbangan untuk reaksi H2 (g) + I2 (g) ⇄2 HI (g) adalah sebagai berikut.

Reaksi nomor 2) semua fase zat pada pereaksi merupakan gas (g) dan semua fase zat pada produk adalah solid (s). Hanya fase zat gas (g) yang mempengaruhi nilai tetapan kesetimbangan. Sehingga, tetapan kesetimbangan untuk reaksi NH3 (g) + CO2 (g) ⇄ NH2CO2NH4 (s) adalah sebagai berikut.

Reaksi nomor 3) terdapat fase zat campuran (aq) dan solid (s). Hanya fase zat (aq) yang mempengaruhi nilai tetapan kesetimbangan. Sehingga, tetapan kesetimbangan untuk reaksi Cu2+ (aq) + Zn (s) ⇄Zn2+ (aq) + Cu (s) adalah sebagai berikut.
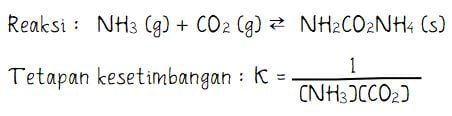
Demikianlah tadi ulasan pengertian apa itu kesetimbangan kimia. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: [Praktikum Kimia] Faktor-Faktor yang Mempengaruhi Laju Reaksi
