Praktikum kimia hukum kekekalan massa: Sebuah kayu yang dibakar kemudian akan menjadi abu. Jika kedua benda tersebut ditimbang maka massa abu akan lebih ringan dari massa antara kayu. Padahal seluruh komponen kayu telah berubah menjadi abu. Contoh lain misalnya pada besi yang berkarat. Antara massa besi sebelum dan sesudah berkarat akan menunjukkan perbedaan massa antara keduanya. Massa besi berkarat akan lebih berat dari massa besi sebelum berkarat. Mengapa kondisi ini bisa terjadi?
Seorang tokoh kimia bernama Antonie Laurent Lavoisier kemudian menjelaskan peristiwa tersebut melalui sebuah hukum yang disebut hukum kekekalan massa. Dalam percobaan yang dilakukannya, disimpulkan bahwa massa zat sebelum reaksi sama dengan massa zat sesudah reaksi. Penjelasan pada reaksi kayu menjadi abu atau besi berkarat dikarenakan proses reaksi terjadi di sistem terbuka. Di mana zat hasil reaksi yang keluar dari sistem atau masuk dalam sistem tidak ikut teramati.

Baca Juga: Hukum Perbandingan Tetap (Hukum Proust)
Apa saja tujuan, dan alat/bahan yang dibutuhkan pada praktikum kimia hukum kekekalan massa? Bagaimana langkah kerja pada praktikum kimia hukum kekekalan massa? Bagaimana bentuk laporan praktikum kimia hukum kekekalan massa? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Tujuan, Alat/Bahan, dan Proses pada Praktikum Kimia Hukum Kekekalan Massa
- Pembahasan Praktikum Hukum Kekekalan Massa
- Kesimpulan apa yang dapat ditarik dari percobaan 1 dan 2?
Tujuan, Alat/Bahan, dan Proses pada Praktikum Kimia Hukum Kekekalan Massa
Tujuan Praktikum Kimia Hukum Kekekalan Massa:
1) Mengamati hubungan massa zat-zat sebelum dan sesudah reaksi.
Alat dan Bahan:
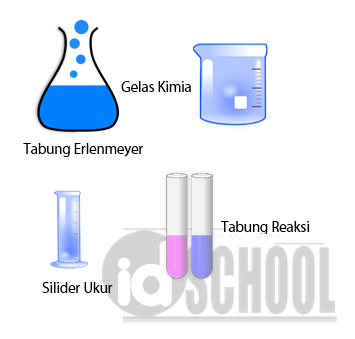
Daftar alat yang digunakan pada praktikum kimia hukum kekekalan massa sesuai dengan daftar berikut.
- Neraca: 1 buah
- Gelas kimia 500 mL: 1 buah
- Tabung reaksi: 2 buah
- Tabung erlenmeyer: 1 buah
- Silinder ukur 10 mL: 1 buah
- Pipet: 1 buah
Daftar bahan yang digunakan pada praktikum kimia hukum kekekalan massa sesuai pada daftar berikut.
- NaOH (natrium hidroksida) 0,1 M
- KI (kalium iodida) 0,1 M
- Pb(NO3)2 (timbal (II) nitrat) 0,1 M
- CuSO4 (tembaga(II) sulfat) 0,1 M
Baca Juga: Konsep Mol pada Perhitungan Kimia
Cara Kerja:
- Reaksi Pb(NO3)2 dan KI:
- Ambil larutan Pb(NO3)2 sebanyak 3 ml menggunakan gelas ukur
- Masukkan larutan Pb(NO3)2 sebanyak 3 ml yang telah ditakar ke dalam tabung reaksi kemudian timbang massa larutan dan catat hasilnya
- Cuci gelas ukur
- Ambil larutan KI sebanyak 3 ml menggunakan gelas ukur
- Masukkan larutan KI sebanyak 3 ml yang telah ditakar ke dalam tabung reaksi kemudian timbang massa larutan dan catat hasilnya
- Mengambil zat dari tabung reaksi dan masukkan cairan dalam tabung reaksi ke dalam labu Erlenmeyer
- Catat hasil campuran kedua zat Pb(NO3)2 + KI
- Timbang massa larutan dan catat hasilnya
- Reaksi NaOH dan Cu(SO)4 :
Ulangi langkah seperti pada reaksi Pb(NO3)2 dan KI dengan menggunakan campuran larutan kedua yaitu NaOH + CuSO4
Baca Juga: Perhitungan Kimia – Konsep Mol
Pembahasan Praktikum Hukum Kekekalan Massa
Hasil yang diperoleh dari praktikum hukum kekekalan massa:
- Reaksi Pb(NO3)2 + KI:
- Massa sebelum bercampur = 13,59 gram + 9,36 gram = 22,95 gram
- Massa setelah bercampur = 22,95 gram
- Warna larutan Pb(NO3)2 0,1 M sebelum reaksi bening
- Warna larutan KI 0,1 M sebelum reaksi bening
- Setelah terjadi reaksi antara Pb(NO3)2 dan KI warnanya berubah menjadi kuning oranye.
- Reaksi NaOH dan CuSO4:
- Massa sebelum bercampur = 6,39 gram + 10,8 gram = 17,19 gram
- Massa setelah bercampur = 17,19 gram
- Warna larutan NaOH sebelum reaksi bening
- Warna larutan CuSO4 sebelum reaksi bening kebiruan
- Setelah terjadi reaksi antara NaOH dan CuSO4 warnanya berubah menjadi biru pekat.
Kesimpulan apa yang dapat ditarik dari percobaan 1 dan 2?
Berikut ini beberapa kesimpulan yang dapat diperoleh dari percobaan 1 dan 2.
- Pada percobaan pertama yaitu reaksi antara Pb(NO3)2 dan KI terjadi perubahan warna dari bening menjadi kuning oranye. Meskipun terjadi perubahan warna pada hasil setelah reaksi namun massa larutan antara sebelum dan sesudah reaksi adalah sama atau tidak terjadi peruberubahan.
- Pada percobaan kedua yaitu reaksi antara NaOH dan CuSO4 membuat warna dari kedua larutan setelah dicampur menjadi biru pekat. Terjadi perubahan warna setelah adanya reaksi NaOH dan CuSO4. Setelah terjadi reaksi, massa larutan sebelum reaksi sama dengan massa larutan sesudah reaksi.
- Kesimpulannya adalah reaksi tidak mengubah massa zat yang bereaksi.
Hasil praktikum hukum kekekalan massa yang dilakukan sesuai dengan bunyi hukum kekekalan massa yaitu massa sebelum reaksi sama dengan massa setelah reaksi.
Demikianlah tadi ulasan tentang praktikum kimia hukum kekekalan massa yang meliputi pengantar hukum kekekalan massa, alat bahan dan proses praktikum hukum kekekalan massa, serta kesimpulan dan pembahasan praktikum hukum kekekalan massa. Terima kasih sudah mengunjungi idschoo(dot)net, semoga bermanfaat.
Baca Juga: Praktikum Biologi – Uji Fotosintesis
