Hukum Perbandingan Tetap untuk pertama kalinya dikenalkan oleh seorang kimiawan bernama Joseph Louis Proust sehingga disebut juga sebagai hukum proust. Melalui hukum perbandingan tetap, Proust mengenalkan besarnya perbandingan pada pembentukan senyawa. Seperti yang diketahui bahwa komposisi kimia ditunjukkan oleh rumus kimia untuk nama sebuah senyawa. Di mana dua unsur bergabung dan masing – masing menyumbangkan sejumlah atom tertentu untuk membentuk suatu senyawa. Hasil eksperimen yang dilakukan proust menunjukkan bahwa perbandingan massa unsur – unsur penyusun suatu senyawa selalu tertentu dan tetap.
Contoh perbandingan tetap pada pembentukan senyawa air (H2O ) dari unsur hidrogen (H) dan oksigen. Diketahui pembentukan senyawa H2O dari unsur hidrogen dan oksigen dengan perbandingan 1 : 8. Artinya setiap 1 satuan hidrogen yang bereaksi dengan 8 satuan oksigen akan membentuk terbentuk senyawa 9 satuan H2O.
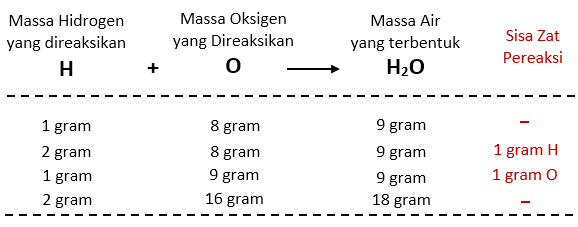
Perhatikan ilustrasi yang diberikan seperti tabel di atas. Setiap 1 gram gas hidrogen bereaksi dengan 8 gram oksigen akan menghasilkan 9 gram air. Berlaku untuk kelipatannya dan akan menghasilkan sisa jika perbandingan antara kedua unsur pembentuk senyawa tidak memiliki perbandingan yang tepat. Terlihat juga bahwa kandungan dalam air memiliki perbandingan yang tetap yaitu 1 : 8 untuk hidrogen dan oksigen, berapapun banyaknya air yang terbentuk.
Baca Juga: Sifat Periodik Unsur
Melalui halaman ini, sobat idschool akan mempelajari hukum perbandingan tetap atau hukum proust yang meliputi bunyi hukum proust, rumus hukum perbandingan tetap, dan contoh soal hukum perbandingan tetap. Simak ulasan lebih lanjut pada masing – masing bahasan di bawah.
Table of Contents
- Bunyi Hukum Perbandingan Tetap (Hukum Proust)
- Rumus Hukum Perbandingan Tetap (Hukum Proust)
- Contoh Soal Hukum Perbandingan Tetap dan Pembahasan
Bunyi Hukum Perbandingan Tetap (Hukum Proust)
Bayangkan sobat idschool saat membuat adonan kue. Untuk mendapatkan kue yang lezat tentu saja membutuhkan takaran dari bahan – bahan yang sesuai. Jika bahan yang digunakan tidak memiliki takaran sesuai perbandingan yang tepat maka bisa jadi kue tidak akan jadi. Contoh kasus lain pada pembuatan adukan semen untuk bahan bangunan. Agar menghasilkan beton yang kokoh takaran semen, pasir, dan air harus memiliki perbandingan yang tepat.
Seperti beberapa peristiwa yang terjadi di kehidupan sehari – hari sobat idschool, massa unsur – unsur penyusun suatu senyawa memiliki perbandingan. Joseph Louis Proust mengenalkan hukum perbandingan tetap atau yang disebut juga sebagai Hukum Proust. Bunyi hukum proust menyatakan perbandingan massa unsur – unsur penyusun dalam satu senyawa adalah tertentu dan tetap.
Hukum Perbandingan Tetap:
perbandingan massa unsur – unsur penyusun dalam satu senyawa adalah tertentu dan tetap.

Hukum Proust memiliki peranan penting untuk menunjukkan hubungan kuantitatif antara zat – zat yang terlibat dalam reaksi kimia.
Baca Juga: Hukum Perbandingan Berganda Dalton
Rumus Hukum Perbandingan Tetap (Hukum Proust)
Penjabaran Hukum Proust dapat digunakan untuk menentukan kadar unsur atau massa unsur dalam senyawa. Sebagai contoh senyawa dengan rumus kimia AmBn. Rumus menentukan kadar unsur atau massa dalam senyawa diberikan seperti persamaan di bawah.

Penggunaan rumus hukum perbandingan tetap yang diberikan di atas dapat dilihat pada contoh soal dan penyelesaiannya berikut ini.
Tentukan kadar C dalam 50 gram CaCO3 adalah!
Contoh soal
Penyelesaian:
Langkah untuk menentukan kadar C dalam 50 gram CaCO3 dilakukan dengan menentukan massa C dalam CaCO3 terlebih dahulu. Selanjutnya dari hasil hitung massa C dapat diperoleh kadar C dalam CaCO3.
Menentukan massa C:
massa C = Ar C/Mr CaCO3 × massa CaCO3
= 12/100 × 50 = 6 gram
Menentukan kadar C:
Kadar C = massa C/massa CaCO3 × 100%
Kadar C = 6/50 × 100% = 12%
Jadi, kadar C dalam 50 gram CaCO3 adalah 12%
Baca Juga: Hukum Kekekalan Massa – Lavoisier
Contoh Soal Hukum Perbandingan Tetap dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1: Soal Perbandingan Hukum Tetap

Perbandingan unsur nitrogen dan hidrogen pada pembentukan amonia adalah 14 : 3. Jika 28 gram gas nitrogen dan 9 gram gas hidrogen direaksikan, maka massa amonia yang terbentuk dan banyak zat yang bersisa berturut – turut adalah ….
A. 34 gram amonia dan 6 gram hidrogen
B. 34 gram amonia dan 3 gram hidrogen
C. 34 gram amonia dan 6 gram nitrogen
D. 34 gram amonia dan 3 gram nitrogen
E. 3 gram amonia dan 34 gram hidrogen
Pembahasan:
Hasil bagi setiap pereaksi dengan pembandingnya:
N = 28/14 = 2
H = 9/3 = 3
Diperoleh hasil bagi setiap pereaksi dengan pembandingnya berturut – turut adalah 2 dan 3. Nilai hasil bagi nitrogen lebih kecil (yaitu 2). Sehingga, pereaksi yang akan habis terlebih dahulu adalah nitrogen.
Massa hidrogen yang bereaksi adalah nilai hasil bagi terkecil dari kedua unsur yaitu 2 kemudian dikalikan pembanding hidrogen yaitu 3. Jadi, massa hidrogen yang bereaksi adalah massa Hreaksi = 2 × 3 = 6 gram.
Sisa hidrogen yang tidak beraksi sama dengan massa hidrogen yang tersedia dikurangi massa hidrogen yang bereaksi: massa Hsisa = 9 gram – 6 gram = 3 gram.
Massa amonia (NH3) yang terbentuk:
= massa Hreaksi +massa Nsemua
= 6 gram + 28 gr
= 34 gr
Jadi, massa senyawa amonia yang terbentuk dan massa sisa pereaksi berturut-turut adalah 34 gram amonia dan 3 gram massa hidrogen.
Jawaban: B
Baca Juga: Cara Menghitung Ar dan Mr Suatu Senyawa
Contoh 2: Soal Hukum Proust (Hukum Perbandingan Tetap)
Perbandingan massa karbon terhadap oksigen dalam senyawa CO¬2 adalah 3 : 8. Jika digunakan 18 gram unsur C dan 40 gram unsur O maka massa senyawa CO2 yang terbentuk dan sisa pereaksi berturut – turut adalah ….
A. 55 gram CO2 dan 3 gram unsur O
B. 55 gram CO2 dan 3 gram unsur C
C. 55 gram CO2 dan 5 gram unsur O
D. 3 gram CO2 dan 55 gram unusr C
E. 5 gram CO2 dan 55 gram unsur O
Pembahasan:
Hasil bagi setiap pereaksi dengan pembandingnya: C =\frac{18}{3} = 6; O =\frac{40}{8} = 5 ]
Di mana diperoleh hasil perbandingan sama dengan 6 dan 5. Unsur yang akan habis pereaksi adalah unsur dengan hasil banding paling terkecil, dalam masalah ini adalah unsur oksigen dengan hasil pembanding 5 yang akan habis bereaksi terlebih dahulu.
Massa karbon yang bereaksi adalah nilai hasil bagi terkecil dari kedua unsur (dalam soal ini adalah 5) dikali pembanding karbon (yaitu sama dengan 3). Jadi, massa karbon yang bereaksi adalah massa Creaksi = 5 × 3 = 15 gram.
Sisa karbon yang tidak beraksi sama dengan massa karbon yang tersedia dikurangi massa karbon yang bereaksi, yaitu massa Csisa = 18 gram – 15 gram = 3 gram.
Massa karbon dioksida (CO2) yang terbentuk adalah massa karbon yang bereaksi ditambah semua massa oksigen (karena habis bereaksi).
Hitung massa (CO2) yang terbentuk:
massa CO2 = massa Creaksi + massa Osemua
massa CO2 = 15 gram + 40 gram
massa CO2 = 55 gram
Jadi, massa senyawa CO2 yang terbentuk dan massa sisa pereaksi berturut – turut adalah 55 gram massa CO2 dan 3 gram massa C.
Jawaban: A
Demikianlah tadi ulasan materi mengenai hukum perbandingan tetap atau hukum proust. Meliputi contoh hukum perbandingan tetap dalam kehidupan sehari – hari, rumus hukum perbandingan tetap, dan contoh soal hukum perbandingan tetap. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Rumus Molekul dan Rumus Empiris

contoh 2 hukum proust, harusnya jawabannya B bukan A.