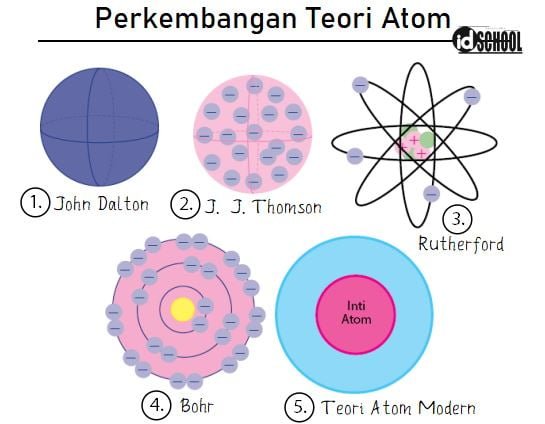
Perkembangan teori atom terdiri dari lima teori yang disampaikan oleh beberapa tokoh dunia. Kata atom berasal a yang berarti tidak dan TOMos yang berarti dipotong-potong. Sehingga, dapat disimpulkan bahwa atom adalah tidak dipotong-potong. Pengertian awal dari atom ini disampaikan oleh John Dalton yang mengemukakan bahwa atom adalah bagian terkecil penyusun benda. Dalam perkembangan teori atom, teori oleh Dalton tersebut nyatanya memiliki kekurangan yang pertama disampaikan oleh J. J. Thomson. Teori atom dari Thomson menyatkan bahwa di dalam atom terdapat elektron. Setelah J. J. Thomson mengemukakan pendapatnya, banyak perkembangan teroi atom yang bermunculan.
Selain John Dalton dan J. J. Thomon, ada beberapa tokoh yang menymbang pemikiran pada perkembangan teori atom. Tokoh-tokoh pada perkembangan teori atom antara lain adalah Rutherford, Neils Bohr, Werner Heisenberg, dan Schrodinger.
Perkembangan teori atom yang berawal dari konsep yang dikemukakan oleh John Dalton berkembang sampai teori atom modern yang dikemukakan oleh Heisenberg dan Schrodinger. Teori atom modern inilah yang masih dipakai sampai saat ini. Bagaimanakah perjalanan dari perkembangan teori atom dari masa ke masa? Sobat idshcool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: 5 Dasar Hukum Kimia
Teori Atom John Dalton
Tokoh dari perkembangan teori atom yang pertama adalah John Dalton. Pada tahun 1803, John Dalton mengemukakan pendapatnya tentang atom. Teori atom yang dikemukakan Dalton didasarkan pada dua hukum, yaitu hukum kekekalan massa dan susunan tetap.
- Hukum kekekalan massa (Hukum Lavoisier): massa total zat-zat sebelum reaksi akan selalu sama dengan massa total zat-zat hasil reaksi.
- Hukum susunan tetap (Hukum Prouts): Perbandingan massa unsur-unsur dalam suatu senyawa selalu tetap.
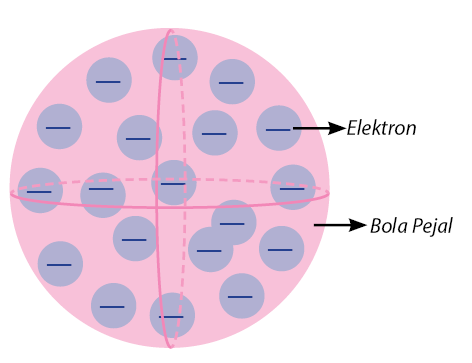
Bentuk atom yang dikemukakan oleh Dalton berbentuk seperti bola pejal. Berikut ini adalah gambaran bentuk atom menurut John Dalton.
Kesimpulan dari tori atom John Dalton:
- Merupakan partikel terkecil dari suatu materi sehingga tidak dapat dibagi lagi menjadi bagian yang lebih kecil.
- Tidak dapat diciptakan atau dimusnahkan.
- Digambarkan seperti bola pejal sederhana dengan ukuran sangat kecil.
- Penyusun unsur adalah atom-atom yang sama.
- Penyusun senyawa adalah atom-atom yang berbeda sesuai unsur penyusunnya.
- Atom-atom bergabung membentuk senyawa dengan perbandingan bilangan bulat dan sederhana.
Kelebihan Teori Atom Dalton:
- Mampu membangkitkan minat terhadap penelitian tentang model atom berikutnya.
Kelemahan Teori John Dalton:
- Tidak bisa mejelaskan hubungan antara larutan senyawa dan daya hantar arus listrik.
Perkembangan Teori Atom oleh J. J. Thomson
Perkembangan teori atom yang kedua dikemukakan oleh J. J. Thomson. Penemuan tabung katode oleh William Crookers membantu J. J. Thomson dapat menemukan teori atom baru. Melalui tabung katode, J. J Thomson memastikan bahwa sinar katode merupakan partikel karena dapat memutar baling-baling yang diletakkan diantara katode dan anode.
Hasil dari percobaan ini membuktikan bahwa sinar katode merupakan partikel penyusun atom yang bermuatan negatif (selanjutnya disebut elektron). Secara ringkas, Thomson menyimpulkan bahwa atom adalah bola padat bermuatan positif dan di dalamnya tersebar elektron yang bermuatan negatif.
Model atom Thomson digambarkan seperti kismis(elektron) yang berada pada roti (atom).
Kesimpulan Teori Atom J. J Thomson
- Atom merupakan bola pejal yang bermuatan positif dan didalamya tersebar muatan negatif elektron.
Kelebihan:
- Menjadi awal penemuan bahwa atom bukan partikel terkecil sehingga memberi jalan untuk teori-teori selanjutnya.
Kelemahan:
- Thomson tidak dapat menjelaskan susunan muatan positif dan negatif dalam bola atom tersebut.
Baca Juga: Cara Menghitung Massa Atom Relatif (Ar) dan Molekul Relatif (Mr)
Teori Atom Rutherford
Teori atom Rutherford muncul berdasarkan eksperimen hamburan sinar alfa dari uranium. Rutherford bersama dua orang muridnya (Hans Geiger dan Erners Masreden) melakukan percobaan yang dikenal dengan hamburan sinar α (alfa). Partikel alfa adalah partikel yang bermuatan positif dan bergerak lurus dan berdaya tembus besar, sehingga dapat menembus lembaran tipis kertas.
Awalnya, percobaan tersebut bertujuan untuk menguji pendapat Thomson mengenai atom berupa bola pejal yang bermuatan negatif. Hasil dari percobaan Rutherford adalah hampir semua partikel alfa diteruskan. Jika lempeng emas tersebut dianggap sebagai satu lapisan atom-atom emas, maka di dalam atom emas terdapat partikel yang sangat kecil yang bermuatan positif.
Kemudian Rutherford mengusulkan model atom yang menyatakan bahwa atom terdiri dari inti atom yang terdiri dari proton (+) dan meutron (n) dan dikelilingi oleh elektron (bermuatan negatif).
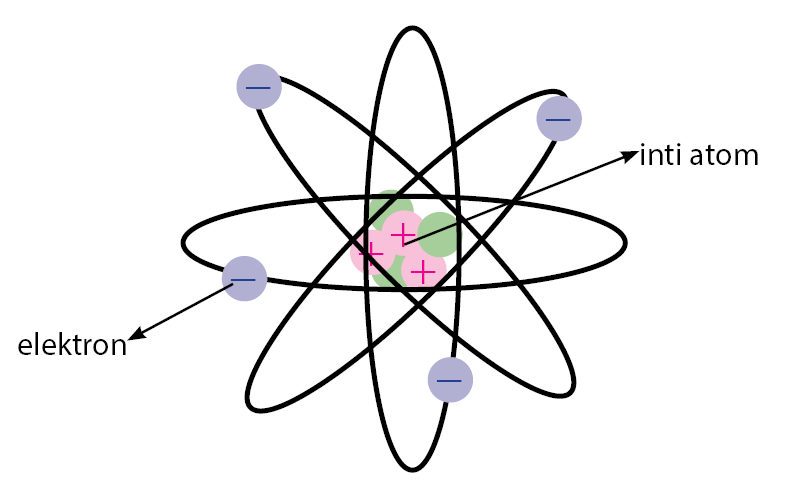
Kesimpulan Teori Atom Rutherford:
- Atom bukan merupakan bola pejal.
- Terdiri dari inti atom yang sangat kecil dan bermuatan positif.
- Inti Atom dikelilingi oleh elektron yang bermuatan negatif.
- Di dalam inti atom juga terdapat partikel netral yang berfungsi mengikat partikel-partikel positif agar tidak saling tolak menolak.
Kelebihan:
Mampu mengemukankan ide mengenai inti atom untuk pertama kalinya.
Kelemahan:
Tidak dapat menjelaskan mengapa elektron tidak jatuh ke dalam inti atom. Elektron yang mengelilingi inti atom mengeluarkan energi sehingga ada pasti saat elektron dapat jatuh ke inti atom.
Baca Juga: Cara Menentukan Jumlah Proton, Elektron, dan Neutron dalam Suatu Atom
Perkembangan Teori Atom oleh Bohr
Perkembangan teori atom terus berlanjut pada tahun 1913, Niels Bohr mengembagkan teori model atom Rutherford menggunakan percobaan spektrum hidrogen. Percobaan ini berhasil memberikan gambaran keadaan elektron dalam menempati daerah disekitar inti atom. Penjelasan Bohr tentang atom hidrogen melibatkan gabungan antara teori klasik dari Rutherford dan teori kuantum dari Planck.
Empat postulat hasil percobaan Niels Bohr:
- Hanya ada seperangkat orbit tertentu yang diperbolehkan bagi satu elektron dalam atom hidrogen. Orbit ini dikenal sebagai keadaan gerak stasioner elektron dan merupakan lintasan melingkar disekeliling inti.
- Elektron tidak memancarkan atau menyerap energi selama elektron berada dalam lintasan stasioner, sehingga energinya tetap.
- Elektron hanya dapat berpindah dari satu lintasan stasioner ke lintasan stasioner lain.
- Lintasan stasioner yang dibolehkan memilki besaran dengan sifat-sifat tertentu, terutama sifat yang disebut momentum sudut.
Dalam bentuk gambar, ilustrasi teori atom Bohr dapat dilihat seperti berikut.
Kesimpulan Teori Atom Bohr
Atom terdiri atas inti atom yang bermuatan positi dan elektron-elektron yang mengelilingi inti atom pada lintasan-lintasan tertentu. Litasan-lintasan tersebut disebut kulit elektron atau tingkat energi. Tingkat energi paling rendah terdapat pada kulit elektron yang terletak paling dalam. Sedangkan tingkat energi paling besar terletak pada kulit elektron paling luar. Semakin jauh dari inti atom (semakin besar nomor kulitnya) maka tingkat energinya akan semakin tinggi.
Teori atom Bohr juga masih memiliki kekurangan, berikut ini adalah kelebihan dan kekurangan teori atom Bohr.
Kelebihan:
- Dapat menjelaskan kekurangan dari teori atom Rutherford. Dapat menjelaskan mengapa elektron tidak jatuh ke inti atom.
Kelemahan:
- Model atom ini tidak bisa menjelaskan spektrum warna dari atom berelektron banyak.
Teori atom yang digunakan saat ini adalah teori atom modern oleh Heisenberg dan Schrodinger yang akan kita ulas pada pembahasan di bawah.
Perkembangan Teori Atom Modern
Teori Atom modern dikenal juga dengan teori atom mekanika kuantum yang juga dikenal sebagai prinsip ketidakpastian. Tokoh pertama dari teori atom modern adalah seorang ahli dari Jerman bernama Werner Heisenberg.
Teori atom modern menyatakan kedudukan dan momentum suatu benda secara seksama pada saat bersamaan tidak mungkin dapat ditentukan. Kondisi yang dapat ditentukan adalah kebolehjadian menemukan elektron pada jarak tertentu dari inti atom.
Erwin Schrodinger melengkapi teori mekanika kuantum melalui suatu persamaan untuk mendapatkan fungsi gelombang. Fungsi gelombang tersebut digunakan untuk menggambarkan batas kemungkinan ditemukannya elektron dalam tiga dimensi. Schrodinger juga merumuskan bentuk dan tingkat energi orbital. Orbital merupakan daerah ruang di sekitar inti dengan kebolehjadian untuk mendapatkan elektron.
Orbital juga menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit. Kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital.
Teori atom modern dalam gambar dapat terlihar seperti berikut.
Kesimpulan Model Atom Mekanika Gelombang:
Elektron-elektron yang mengelilingi inti atom memiliki tingkat energi tertentu tetapi keberadaannya tidak dapat dipastikan. Posisi elektron dapat ditemukan melalui fungsi gelombang tertentu dalam kulit atom yang disebut sebagai daerah kebolehjadian paling besar untuk menemukan elektron. Elektron menempati orbital yang dinyatakan dalam bilangan kuantum.
Gerakan elektron memiliki sifat gelombang. Gerak tersebut mengikuti penyelesaian kuadrat fungsi gelombang yang disebut orbital. Orbital merupakan bentuk tiga dimensi dari kebolehjadian paling besar ditemukannya elektron dengan keadaan tertentu dalam suatu atom.
Orbital juga menggambarkan tingkat energi elektron. Orbital-orbital dengan tingkat energi yang sama atau hampir sama akan membentuk sub kulit. Beberapa sub kulit bergabung membentuk kulit. Kulit terdiri dari beberapa sub kulit dan subkulit terdiri dari beberapa orbital.
Sekian pembahasan mengenai perkembangan teori atom yang memuat kelemahan dan kekurangan teori atom. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: 4 Aturan Konfigurasi Elektron s p d f pada Teori Mekanika Kuantum