Titrasi asam basa adalah suatu teknik yang digunakan untuk mengetahui konsentrasi suatu larutan asam basa. Langkah kerja yang dilakukan dalam proses praktikum adalah meneteskan titran tetes demi tetes dari buret ke dalam labu erlenmeyer yang berisi titer. Proses dilakukan sampai mencapai keadaan ekuivalen yaitu saat titran dan titer tepat habis bereaksi (secara stoikiometri).
Pada keadaan ekuivalen dalam proses praktikum titrasi asam basa mencapai titik ekuivalen. Pada saat proses yang dilakukan mencapai titik ekuivalen, maka proses titrasi dihentikan.
Dari titik ekuivalen dapat diketahui volume titran yang diperlukan saat mencapai titik ekuivalen. Volume yang dibutuhkan ini kemudian digunakan dalam perhitungan.
Apa saja alat yang dibutuhkan pada praktikum titrasi asam basa? Bagaimana langkah kerja praktikum titrasi asam basa? Bagaimana bentuk laporan praktikum titrasi asam basa? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Daftar isi:
Baca Juga: Praktikum Kimia untuk Menentukan Perubahan Entalpi (ΔH) dengan Kalorimeter
Tujuan Praktikum Titrasi Asam Basa
Adapun tujuan praktikum titrasi asam basa meliputi:
1) Menentukan kemolaran atau konsentrasi larutan
2) Mengetahui proses penetralan asam basa dengan metode titrasi
3) Memahami dan mengetahui proses kerja titrasi asam basa
Landasan Teori Praktikum Titrasi Asam Basa
Larutan asam kuat memiliki ion hidrogen (H+), sementara basa kuat memiliki ion hidroksida (OH‒). Diketahui bahwa asam kuat dan basa kuat dalam air akan terurai sempurna. Sehingga ion hidrogen dan hidroksida dalam proses titrasi dapat langsung dihitung dari jumlah asam atau basa yang ditambahkan.
Titrasi adalah sebuah proses untuk menentukan kadar suatu larutan (yang belum diketahui konsentrasinya) menggunakan larutan standar yang telah diketahui konsentrasinya. Larutan yang akan dicari konsentrasi atau kadarnya pada praktikum titrasi asam basa disebut titrat atau analit.
Sedangkan larutan yang telah diketahui konsentrasinya disebut dengan titer atau titran. Larutan yang kosentrasinya telah diketahui (titran/titer) pada praktikum titrasi asam basa merupakan larutan standar atau larutan baku.
Prinsip kerja dari titrasi berdasarkan pada reaksi penetralan yaitu kadar larutan asam ditentukan dengan larutan basa, begitu juga dengan sebaliknya.
Langkah kerja dalam praktikum titrasi asam basa dilakukan dengan mengupayakan titran dan titrat habis bereaksi. Pada saat titran dan tirat habis bereaksi memenuhi kondisi mol asam sama dengan mol basa.
Titik di mana saat kondisi mol asam sama dengan mol basa disebut dengan titik ekuivalen.
Cara menentukan titik ekuivalen dapat dilakukan dengan bantuan indikator asam basa. Indikator ini ditambahkan pada titran sebelum melakukan proses titrasi. Penambahan indikator diusahakan sesedikit mungkin dan umumnya adalah 2 ‒ 3 tetes menggunakan pipet.
Perubahan warna saat titran yang telah ditambahkan indikator menjadi tanda bahwa proses yang berlangsung telah mencapai titik ekivalen. Proses titrasi segera dihentikan saat mulai mulai terjadi perubahan warna larutan.
Atau dapat dikatakan bahwa kondisi saat terjadinya perubahan warna indikator menjadi titik akhir titrasi. Besar volume titran yang dibutuhkan selama proses titrasi digunakan dalam perhitungan.
Hubungan kemolaran larutan asam asa pada proses titrasi pada titik ekuivalen memenuhi persamaan berikut.

Keterangan:
a = valensi asam (jumlah ion H+)
Va = volume larutan asam
Ma = konsentrasi larutan asam
b = valensi basa (jumlah ion OH–)
Vb = volume larutan basa
Mb = konsentrasi larutan basa
Baca Juga: Cara Pemekatan dan Pengenceran Larutan
Alat dan Bahan yang Dibutuhkan pada Praktikum Titrasi Asam Basa
Daftar alat dan bahan yang dibutuhkan pada praktikum titrasi asam terdapat pada daftar berikut.

Keterangan dan Sumber gambar:
1. Statif dan klem (indonetwork);
2. gelas kimia (qiano laboratory);
3. burette (alatlabor);
4. labu ukur (alatlabor);
5. corong gelas (medicalogy);
6. Labu Erlenmeyer (medicalogy);
Alat yang dibutuhkan:
1. Buret: 1 buah
2. Erlenmeyer: 3 buah
3. Pipet Tetes: 1 buah
4. Gelas kimia 200 cm3: 2 buah
5. Labu takar 100 cm3: 1 buah
6. Corong gelas: 1 buah
7. Statif
Bahan yang dibutuhkan:
1. Larutan HCl (belum diketahui konsentrasinya)
2. NaOH 0,5 M
3. Indikator Fenolftalein
4. Akuades
Baca Juga: [Praktiku Kimia] Faktor-Faktor yang Memengaruhi Laju Reaksi
Langkah Kerja Praktikum Titrasi Asam Basa
Langkah-langkah yang dilakukan dalam melakukan praktikum titrasi asam basa sesuai pada cara-cara berikut.
- Melakukan pengenceran HCl: mengambil larutan HCl sebanyak 5mL, memasukkan ke dalam labu takar 100 cm3, dan menambahkan akuades ke dalam labu takar sampai tanda batas.
- Mengisi buret dengan larutan NaOH 0,5 M sebanyak 50 mL.
- Mengambil 10 mL HCl yang telah diencerkan dan masukkan ke dalam labu erlenmeyer.
- Menambahkan 2 tetes indikator fenolftalein ke dalam larutan HCl pada labu erlemneyer.
- Melakukukan titrasi dengan cara meneteskan larutan NaOH 0,5 M ke dalam labu erlenmeyer yang berisi larutan HCl dan indikator fenolftalein.
- Menggoyangkan labu erlenmeyer secara perlahan selama proses titrasi berlangsung.
- Menghentikan proses titrasi jika larutan dalam labu erlenmeyer telah berubah warna menjadi merah muda dan permanen (tidak hilang saat labu erlenmeyer digoyangkan).
- Mencatat volume NaOH 0,5M yang digunakan.
- Ulangi percobaan yang sama pada langkah 1 – 8 sebanyak 3 kali.
Baca Juga: [Praktikum Kimia] Hubungan Koefisien Reaksi dan Jumlah Mol Reaktan
Hasil Percobaan dan Perhitungan
Dari percobaan yang dilakukan diperoleh hasil yang sesuai seperti pada tabel berikut.
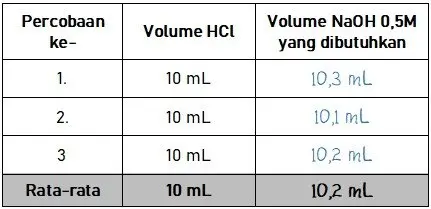
Rata-rata volume NaOH 0,5 M yang dibutuhkan pada hasil percobaan digunakan pada perhitungan untuk menentukan konsentrasi HCl. Perhitungan untuk menentukan konsentrasi HCl dilakukan seperti pada proses berikut.
Diketahui:
Valensi asam: a = 1
Volume asam: Va = 10 mL
Valensi basa: b = 1
Konsentrasi basa: Mb = 0,5 M
Volume basa: Vb = 10,2 mL
Menentukan konsentrasi HCl (Ma):
a × Va × Ma = b × Vb × Mb
1 × 10 × Ma = 1 × 10,2 × 0,5
10 × Ma = 5,1
Ma = 5,1/10 = 0,51 M
Baca Juga: [Praktikum Kimia] Hukum Kekekalan Massa
Pembahasan dan Kesimpulan
Berdasarkan hasil percobaan dan perhitungan diperoleh bahwa konsentrasi HCl yang digunakan pada praktikum titrasi asam basa sama dengan 0,51 M.
Pada awalnya, larutan NaOH dan larutan HCl yang telah ditambahkan indikator dalam kondisi bening. Pada awal proses titrasi belum terjadi perubahan warna pada HCl dalam labu erlenmeyer.
Setelah penambahan NaOH 0,5 M mencapai sejumlah 10 mL mulai terlihat adanya perubahan warna larutan HCl dalam labu erlenmeyer menjadi merah muda.
Kesimpulan yang dapat diambil adalah titik ekuivalen pada proses titrasi yang dilakukan terdapat pada saat penambahan 10,1 mL NaOH.
Kondisi tersebut merupakan titik akhir titrasi yang ditandai dengan adanya perubahan warna larutan HCl dalam labu erlenmeyer. Pada kondisi tersebut, saat ion asam dan basa tepat habis bereaksi atau saat mol asam sama dengan mol basa.
Sekian ulasan praktikum titrasi asam basa yang meliputi cara kerja dan contoh bentuk laporannya. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: 5 Hukum Dasar Kimia

Halo , salam, Bukannya yang berubah warna titrat ya ? Bukan titran ,coba cek lagi terimakasih
Halo Tama, titrat adalah larutan yang belum diketahui kosentrasinya dan titran adalah larutan standar yang sudah diketahui konsentrasinya. Perubahan warna terjadi pada titrat yang telah ditetesi titran (+indikator). Terima kasih kunjungan dan komentarnya, sukses selalu…