Rumus tetapan kesetimbangan digunakan pada reaksi kimia yang berlangsung dua arah. Simbol tetapan kesetimbangan dinotasikan dengan huruf K yang meliputi Kc dan Kp. Kc adalah tetapan kesetimbangan konsentrasi yang nilainya tetap selama suhu tetap. Sedangkan Kp adalah tetapan kesetimpangan berdasarkan tekanan gas.
Reaksi kimia tidak hanya dapat berlangsung satu aruh (irreversible) namun juga dapat berlangsung dua arah atau bolak-balik (reversible). Perbedaan dari kedua macam reaksi ini dapat dilihat dari penggunaan panah dalam persamaan.

Pada reaksi irreversible, persamaan reaksi menggunakan satu anah panah ke kanan (→) yang menunjukkan arah reaksi. Sedangkan pada reaksi versible, persamaan reaksi menggunakan satu anak panah ke kanan dan satu anak panah ke kiri yang disusun atas-bawah ( ⇄).
Tetapan kesetimbangan Kc dan Kp digunakan pada reaksi kimia yang dapat berlangsung dua arah atau bolak-balik. Bagaimana bentuk rumus tetapan kesetimbangan Kc? Bagaimana bentuk rumus tetapan kesetimbangan Kp? Apa hubungan antara Kc dan Kp? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: Apa Itu Kesetimbangan Kimia?
Rumus Tetapan Kesetimbangan Konsentrasi (Kc)
Hukum Cato Guldberg dan Waage menyatakan bahwa:
Dalam keadaan kesetimbangan pada suhu tetap, hasil kali konsentrasi zat-zat hasil reaksi dibagi dengan hasil kali konsentrasi pereaksi yang sisa dimana masing-masing konsentrasi itu dipangkatkan dengan koefisien reaksinya adalah tetap.
Pernyataan tersebut dapat dinyatakan dalam bentuk matematis dalam persamaan kesetimbangan konsetrasi (Kc) seperti rumus umum di bawah.

Zat-zat yang terdapat dalam kesetimbangan dapat berbentuk padat (s), larutan (aq), gas (g), atau cair (l). Konsentrasi zat yang memengaruhi laju reaksi hanya dari zat-zat dengan fase gas (g) atau larutan (aq). Sehingga, konsentrasi zat yang berpengaruh dalam rumus tetapan kesetimbangan juga hanya zat-zat yang berupa gas atau larutan.
Padatan (s) dan cairan murni (l) tidak mempengaruhi kesetimbangan. Hal ini dikarenakan padatan dan cairan murni tidak berubah meskipun terdapat perubahan volume atau suhu pada kesetimbangan konsnetrasi.
Sebagai contoh, tetapan kesetimbangan untuk reaksi: CaCO3 (s) ⇄ CaO (s) + CO2 (g) adalah Kc = [CO2]. Pada reaksi tersebut, fase gas (g) hanya terdapat pada senyawa CO2 dan fase CaCO3 dan CaO adalah solid (s). Sehingga nilai Kc hanya diperoleh dari besar konsentrasi CO2.
Harga Kc pada suatu reaksi yang sama hanya dipengaruhi suhu. Dengan kata lain, selama suhu tetap maka nilai tetapan kesetimbangan (K) juga akan tetap. Perubahan harga K bergantung jenis reaksinya. Pada reaksi endoterm, harga/nilai K berbanding lurus dengan suhu. Sedangkan pada reaksi eksoterm, harga/nilai K berbanding terbalik dengan suhu.
Baca Juga: Perhitungan Perubahan Entalpi dengan Kalorimeter
Rumus Tetapan Kesetimbangan Tekanan Parsial Gas (Kp)
Tetapan kesetimbangan yang berdasarkan tekanan gas disebut dengan tetapan kesetimbangan parsial atau tekanan pasrial gas. Simbol untuk tetapan kesetimbangann berdasar tekanan gas adalah Kp.
Persamaan rumus kesetimbangan Kp sama dengan hasil kali tekanan parsial gas produk dibagi dengan hasil kali tekanan parsial gas reaktan. Setiap konsentrasi zat pada persamaan kesetimbangan dipangkatkan koefisien reaksinya. Jika koefisien setiap zat sama dengan satu maka tidak perlu dituliskan bilangan pangkatnya.
Rumus tetapan kesetimbangan bedasar tekanan gas (Kp) secara matematis sesuai persamaan berikut.

Baca Juga: Macam-Macam Perubahan Entalpi (ΔH) Standar
Hubungan Kc dan Kp
Antara tetapan kesetimbangan berdasarkan konsentrasi dan tekanan gas memiliki suatu hubungan. Hubungan antara Kc dan Kp dapat ditentukan dalam sebuah persamaan. Melalui persamaan umum gas ideanl pV = nRT dapat diperoleh hubungan antara Kc dan Kp.
Hubungan Kc dan Kp dinyatakan melalui persamaan di bawah.

Dari persamaan hubungan antara Kc dan Kp dapat disimpulkan bahwa nilai Kc sama dengan Kp saat (RT)Δn = 1. Kondisi ini terjadi saat nilai Δn sama dengan 0 atau koefisien gas reaktan sama dengan koefisien gas produk.
Baca Juga: Karakteristik Reaksi Endoterm dan Eksoterm
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Penggunaan Tetapan Kesetimbangan Kc dan Kp
Diketahui harga konstanta kesetimbangan reaksi N2 + 3H2 ⇄ 2NH3 adalah 1/3 dan sebanyak 1,5 mol gas hidrogen dalam volume 1 liter. Banyaknya mol gas nitrogen yang harus dicampurkan agar diperoleh 0,6 gas amoniak dalam kesetimbangan adalah ….
A. 0,6
B. 3,18
C. 3,5
D. 5,18
E. 5,3
Pembahasan:
Misalkan banyak mol nitrogen yang ditcampurkan adalah x, perbandingan mol pada kondisi setimbang diperoleh seperti berikut.

Sehingga koonsentrasi nitrogen (N2), hidrogen (H2), dan NH3 diperoleh seperti berikut.
- [N2] = mol N2 : volume = (x – 0,3) : 1 = x – 0,3
- [H2] = mol H2 : volume = 0,6 : 1 = 0,6
- [NH3] = mol NH3 : volume = 0,6 : 1 = 0,6
Menentukan nilai x:
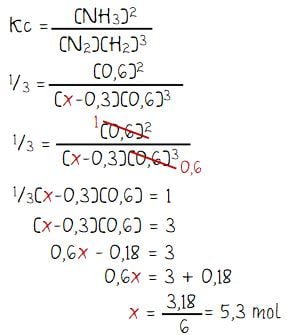
Jadi, banyaknya mol gas nitrogen yang harus dicampurkan agar diperoleh 0,6 gas amoniak dalam kesetimbangan adalah 5,3 mol.
Jawaban: E
Contoh 2 – Soal dan Penggunaan Rumus Tetapan Kesetimbangan Kc dan Kp
Sebanyak 2 mol gas N2 direaksikan dengan 3 mol gas H2 pada suatu ruangan dengan tekanan 5 atm dan suhu 300 oK. Reaksi kesetimbangan N2 + 3H2 ⇄2NH3 menghasilkan 1 mol H2 pada keadaan setimbang. Nilai Kp dari reaksi tersebut adlah ….
A. 0,17
B. 0,67
C. 0,71
D. 1,36
E. 1,80
Pembahasan:
Menentukan mol setiap senyawa yang terlibat pada kondisi setimbang

Menghitung tekanan parsial pada masing-masing gas dan menghitung nilai Kp:

Jadi nilai Kp = 0,71
Jawaban: C
Contoh 3 – Soal Tetapan Kesetimbangan Kc dan Kp
Kesetimbangan berikut yang mempunyayi harga Kc = Kp adalah …
A. H2 (g) + Cl2 (g) ⇄2HCl (g)
B. N2 (g) + 3H2 (g) ⇄2NH3 (g)
C. 2H2 (g) + O2 (g) ⇄ 2H2O (g)
D. CaCO3 (s) ⇄CaO (s) + CO2 (g)
E. CO (g) + H2O (l) ⇄CO2 (g) + H2 (g)
Pembahasan:
Nilai Kc = Kp apabila selisih koefisien antara sisi produk dan sisi reaktan adalah 0. Dengan kata lain, nilai Kc = kP terdapat pada reaksi kesetimbangan dengan total koefisien produk = total koefisien reaktan.
Perlu diingat bahwa senyawa yang digunakan pada tetapan kesetimbangan adalah senyawa dengan fase gas (g) dan larutan (aq). Sedangkan senyawa berwujud padat dan cairan murni tidak terlibat dalam kesetimbangan sehingga koefisiennya tidak ikut dihitung.
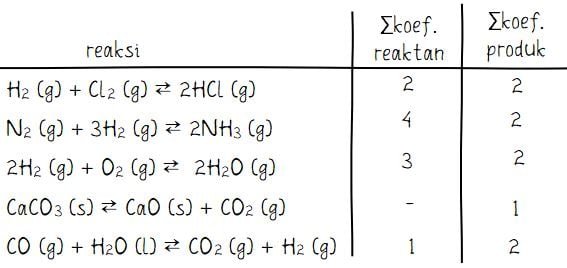
Jadi, kesetimbangan yang mempunyayi harga Kc = Kp adalah H2 (g) + Cl2 (g) ⇄2HCl (g).
Jawaban: A
Demikianlah tadi ulasan rumus tetapan keseimbangan Kc dan Kp. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Cara Menghitung Laju Reaksi dan Faktor-Faktor yang Mempengaruhinya
