Bunyi Hukum Avogadro atau yang biasa disebut juga sebagai hipotesis Avogadro adalah aturan yang menghubungkan antara volume gas dan jumlah molekul gas jika diukur pada suhu dan tekanan yang sama. Hukum Avogadro berhubungan dengan hukum Gay Lussac yang menyatakan perbandingan volume unsur atau senyawa pereaksi dan hasil reaksi sesuai dengan perbandingan koefisiennya. Kemudian, melalui hukum Avogadro dikembangkan lagi sehingga hukum Gay Lussac dapat dikaitkan dengan jumlah molekul.
Hukum Gay Lussac menyimpulkan bahwa perbandingan volume gas – gas yang bereaksi dan volume gas hasil reaksi merupakan perbandingan bilangan bulat dan sederhana pada kondisi temperatur dan tekanan sama. Penemuan Gay Lussac ini dikenal sebagai hukum perbandingan berganda.
Tetapi kemudian timbul pertanyaan, mengapa pada tekanan dan temperatur yang sama perbandingan volume gas yang bereaksi dan hasil reaksi merupakan perbandingan bilangan bulat dan sederhana?
Pertanyaan yang muncul tersebut kemudian dijawab melalui hukum Avogadro yang diperkenalkan oleh Amedeo Avogadro melalui percobaan yang telah dilakukannya.

Baca Juga: Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif
Bagaimana pertanyaan mengenai hukum perbandingan berganda Gay Lussac bisa dijawab melalui bunyi hukum Avogadro? Bagaimana bunyi hukum Avogadro? Dan bagaimana penerapan bunyi hukum Avogadro dalam menyelesaikan permasalahan kimia? Simak penjelasannya pada masing-masing ulasan di bawah.
Table of Contents
Bunyi Hukum Avogadro
Hukum Gay Lussac menyatakan perbandingan volume gas dalam suatu reaksi sesuai dengan koefisien reaksi gas – gas tersebut. Sehingga, jika volume salah satu gas diketahui maka volume gas yang lain dapat ditentukan. Caranya adalah dengan membandingkan koefisien reaksinya.
Percobaan yang dilakukan Avogadro menghasilkan kesimpulan bahwa pembentukan dua molekul uap air dari reaksi antara dua molekul gas hidrogen dan satu molekul gas oksigen. Karena perbandingan volume gas hidrogen, gas oksigen, dan uap air pada reaksi pembentukan uap air adalah 2 : 1 : 2 maka perbandingan jumlah molekul hidrogen, oksigen, dan uap air juga 2 : 1 : 2.
Jumlah atom tiap unsur tidak berkurang atau bertambah dalam reaksi kimia. Sehingga molekul gas hidrogen dan molekul gas oksigen harus merupakan molekul dwiatom, sedangkan molekul uap air harus merupakan molekul triatom.
Kemudian, diperkenalkan hukum Avogadro atau hipotesis Avogadro yang sekarang sedang sobat idschool pelajari.
Bunyi hukum Avogadro: Pada temperatur dan tekanan yang sama, volume yang sama dari semua gas mengandung jumlah molekul yang sama.

Dalam bahasa sederhana, penjelasan bunyi hukum avogadro tersebut dapat juga dikatakan bahwa jumlah molekul atau atom untuk suatu volume gas tidak bergantung pada ukuran atau massa dari molekul gas tersebut. Misalnya 1 liter gas hidrogen (massa atom relatif Ar = 1) dan nitrogen (massa atom relatif Ar = 14) dapat mengandung jumlah molekul yang sama, selama suhu dan tekanan juga sama.
Baca Juga: Cara Menentukan Rumus Kimia dari Suatu Senyawa
Contoh Soal Penerapan Hukum Avogadro dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Penerapan Bunyi Hukum Avogadro
Pada reaksi N2 (g) + 3 H2 (g)→ 2 NH3 (g) untuk 1 liter gas N2 terdapat n molekul. Jumlah molekul H2 yang bereaksi dan jumlah molekul NH3 yang terbentuk jika reaksi berlangsung pada temperatur dan suhu yang sama adalah ….
A. 3n molekul H2 dan 2n molekul NH3
B. 2n molekul H2 dan 2n molekul NH3
C. 2n molekul H2 dan 3n molekul NH3
D. 3n molekul H2 dan 3n molekul NH3
E. 3n molekul H2 dan n molekul NH3
Pembahasan:
Perhatikan koefisien reaksi dan jumlah molekul yang diberikan pada gambar berikut.
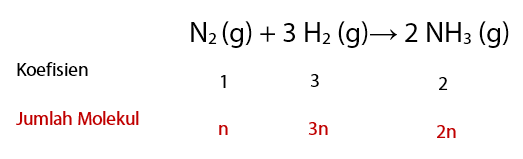
Jumlah molekul H2 yang bereaksi dan jumlah molekul NH3 yang terbentuk jika reaksi berlangsung pada temperatur dan suhu yang sama sesuai dengan perbandingan koefisiennya.
Sehingga untuk 1 liter gas N2 terdapat n molekul maka jumlah molekul H2 yang bereaksi adalah 3n, sedangkan jumlah molekul NH3 yang terbentuk adalah 2n.
Jawaban: A
Baca Juga: Praktikum Kimia – Hubungan Koefisien Reaksi dengan Jumlah Mol Reaktan
Contoh 2 – Soal Penerapan Bunyi Hukum Avogadro

Diketahui sebanyak 9 L gas oksigen mengandung 9,4 × 1022 molekul. Jumlah molekul 36 L gas karbon dioksida dan volume 9,8 × 1023 molekul uap air yang diukur pada suhu dan tekanan yang sama adalah ….
A. 3,67 × 1023 molekul CO2 dan 10,43 L H2O
B. 3,76 × 1023 molekul CO2 dan 10,43 L H2O
C. 3,76 × 1023 molekul CO2 dan 10,34 L H2O
D. 3,67 × 1023 molekul CO2 dan 14,3 L H2O
E. 3,76 × 1023 molekul CO2 dan 14,3 L H2O
Pembahasan:
Pertama adalah menghitung jumlah molekul 36 liter gas karbon dioksida (CO2) seperti pada penyelesaian di bawah.
n CO2/n O2 = V CO2/V O2
n CO2 = V CO2/V O2 × n O2
n CO2 = 36/9 × 9,4 × 1022
n CO2 = 3,76 × 1023 molekul
Selanjutnya, menghitung volume dari 9,8 × 1023 molekul uap air (H2O) yang dapat diketahui melalui perhitungan seperti pada penyelesaian berikut.

Jadi, 36 L gas karbon dioksida memiliki 3,76 × 1023 molekul dan 9,8 × 1023 molekul uap air memiliki volume 10,43 L.
Jawaban: B
Demikianlah tadi ulasan materi tentang bunyi hukum avogadro dan penerapannya. Terima kasih sudah mengunjungi idschoo(dot)net, semoga bermanfaat.
Baca Juga: Praktikum Kimia – Hipotesis Avogadro
