Rumus konsentrasi larutan digunakan untuk mengetahui hubungan kuantitatif antara zat terlarut (solute) dan pelarut (solvent). Nilai konsentrasi dari suatu larutan menyatakan seberapa pekat atau encer larutan tersebut. Semakin tinggi nilai konsentrasi dari suatu larutan berarti larutan semakin pekat. Sebaliknya, rendahnya nilai konsentrasi dari suatu larutan menunjukkan bahwa kondisi larutan tidak pekat atau encer.
Satuan konsentrasi larutan dapat dinyatakan dalam molaritas (M), molalitas (m), faksi mol (x), dan persen massa/volume/massa per volume. Begitu juga untuk mendapatkan konsentrasi larutan dapat diperoleh melalui beberapa persamaan. Persamaan-persamaan dibawah adalah kumpulan rumus konsentrasi larutan dengan berbagai bentuk satuan.

Baca Juga: Konsep Mol pada Perhitungan Kimia
Bagaimana cara melakukan perhitungan besar nilai kosentrasi larutan? Bagaimana penggunaan rumus konsentrasi larutan? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
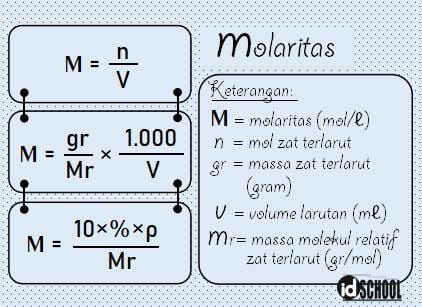
Rumus Konsentrasi Larutan untuk Molaritas (M)
Molaritas adalah konsentrasi jumlah zat terlarut per satuan volume. Atau molaritas juga dapat diartikan dengan banyaknya mol zat per satu liter larutan. Mol adalah satuan jumlah partikel yang berbentuk molekul, atom, atau ion. Satu mol didefinisikan sebagai jumlah zat yang mengandung partikel zat tersebut sebanyak atom yang terdapat dalam 12,000 g atom karbon-12.
Besar molaritas dapat ditentukan melalui persamaan jumlah mol zat terlarut (n) per volume dalam satuan liter. Atau, molaritas sama dengan massa zat terlarut per molekul relatifnya dikali 1.000 per volume dalam satuan mililiter (mL).
Contoh penggunaan rumus molaritas untuk menyelesaikan soal:
Soal1:
Berapakah molaritas dari 4 gram NaOH yang dilarutkan dalam 2 liter air?
Penyelesaian:
Keterangan pada soal memberikan informasi-informasi seperti berikut.
- Massa zat terlarut: gr = 4 gram
- Zat terlarut NaOh → Mr NaOH = 40
- Volume pelarut: V = 2 liter = 2.000 mℓ
Menghitung konsentrasi larutan (molaritas) NaOH:
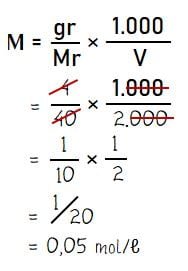
Jadi, molaritas dari 4 gram NaOH yang dilarutkan dalam 2 liter air adalah 0,05 M.
Baca Juga: Tata Nama Senyawa Alkana
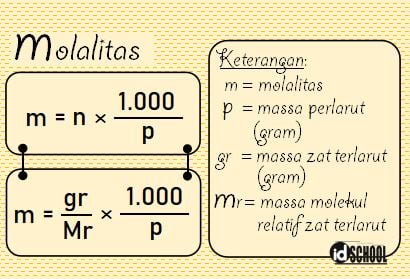
Rumus Konsentrasi Larutan untuk Molalitas (m)
Molalitas adalah besaran yang menyatakan jumlah mol zat terlarut pada setiap satuan berat pelarut. Molalitas menyatakan jumlah partikel zat terlarut (mol) setiap 1 kg pelarut (bukan larutan). Satuan molalitas dinyatakan dalam molal (m). Misalnya, konsentrasi larutan untuk molalitas pada larutan yang dibuat dari 1 mol NaCl yang dilarutkan dalam 1.000 gram sama dengan 1 molal (m).
Perbedaan antara molaritas dan molalitas terdapat pada acuan pelarut. Acuan yang digunakan pada molaritas adalah volume (V) larutan. Sedangkan pada molalitas, acuan yang digunakan adalah massa pelarut (p).
Rumus molalitas dinyatakan seperti persamaan berikut.
Soal 2:
Tentukan kemolalan dari 36 gram glukosa (Mr glukosa = 180) yang dilarutkan dalam 250 gram air!
Penyelesaian:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi seperti berikut!
- Massa glukosa: gr = 36 gram
- Mr glukosa = 180
- Massa pelarut: p = 250 gram
Menghitung konsentrasi larutan glukosa dalam molal:

Jadi, konsentrasi larutan 36 gram glukosa yang dilarutkan dalam 250 gram air sama dengan 0,8 molal.
Baca Juga: Reaksi Reduksi – Oksidasi (Redoks)
Rumus Fraksi Mol
Satuan konsentrasi larutan berikutnya adalah bentuk fraksi mol. Di mana, fraksi mol menunjukkan perbandingan konsentrasi antara zat terlarut dan pelarut. Fraksi merupakan bagian atau pecahan dari suatu kesatuan. Sehingga antara fraksi mol zat terlarut dan pelarut memiliki hubungan jumahnya sama dengan satu.
Persamaan fraksi mol zat terlarut (xt) dan fraksi mol zat pelarut (xp) sesuai rumus berikut.

Contoh penggunaan rumus fraksi mol dapat dilihat seperti pada penyelesaian soal di bawah.
Soal 3:
Sebanyak 60 gram urea (Mr = 60) dilarutkan dalam 72 gram air (Mr = 12). Berapakah fraksi mol urea dalam larutan tersebut?
Penyelesaian:
Keterangan pada soal memberikan informasi-informasi seperti berikut.
- Massa urea: gr = 60 gram
- Massa air (pelarut): p = 72 gram
Menghitung mol urea (mol zat terlarut = nt):
nt = massa urea/Mr urea
nt = 60/60= 1
Menghitung mol air (mol zat perlarut = np):
np = massa air/Mr air
np = 72/18 = 4
Menghitung fraksi mol urea dalam larutan (xt):
xt = nt/(nt + np)
xt = 1/(1 + 4) = 1/5 = 0,2
Jadi, fraksi mol urea dalam larutan tersebut sama dengan 0,2.
Rumus Konsentrasi Larutan dalam Persen/Kadar Massa
Satuan konsentrasi larutan juga dapat dinyatakan dalam bentuk persen atau kadar massa/volume. Cara mendapatkan persen konsentrasi tidak jauh berbeda dengan mendapatkan nilai persentase pada umumnya.
Ada dua bentuk rumus persen/kadar yaitu persen massa dan persen volume. Perbedaan dari keduanya terdapat pada penggunaan besaran massa atau volume. Pada kondisi yang sama, penggunaan rumus persen massa dan persen volume mengasilkan hasil perhitungan akhir yang sama.
Berikut ini adalah persamaan yang sesuai dengan rumus persen/kadar massa konsentrasi suatu larutan.

Contoh penggunaan rumus persen atau kadar massa dapat dilihat seperti pada penyelesaian soal di bawah.
Soal 4:
Suatu larutan mengandung gula pentosa (Mr gula pentosa = 150) dengan konsentrasi 10 molal. Berapakah persen massa gula pentosa dalam larutan tersebut?
Penyelesaian:
Pada laruan gula pentosa sama 10 molal berarti terdapat 10 mol gula pentosa untuk 1 kg pelarut. Sehingga, diperoleh
- Mol gula pentosa: n = 10 mol
- Massa pelarut: p = 1 kg = 1.000 gram
- Massa molekul relatif gula pentosa: Mr = 150
Menghitung massa gula pentosa:
m = mol × Mr
m = 10 × 150 = 1.500 gram
Massa larutan = massa gula pentosa + pelarut
= 1.500 + 1.000
= 2.500
Menghitung persen gula pentosa dalam larutan:

Demikianlah tadi ulasan kumpulan rumus konsentrasi larutan dan contoh penggunannya. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Cara Menentukan Bilangan Oksidasi
