Rumus empiris dan molekul adalah dua bentuk rumus kimia yang dibedakan berdasarkan jumlah unsur-unsur atom penyusunnya. Suatu senyawa dapat tersusun atas unsur-unsur atom yang sama namun memiliki jumlah molekul yang berbeda. Contohnya adalah CH3 (metil) dan C2H6 (etana), di mana kedua senyawa tersebut sama-sama disusun oleh atom karbon karbon (C) dan Hidrogen (H).
Dua senyawa berupa CH3 (metil) dan C2H6 (etana) tersusun oleh atom-atom yang sama namun jumlahnya berbeda. Pada senyawa metil erdapat satu buah atom karon dan tiga atom hidrogen. Sedangkan senyawa etana memiliki dua atom karbon (C) dan 6 atom hidrogen (H).
Senyawa CH3 dan C2H6 merupakan rumus kimia denga jenis yang berbeda. Senyawa CH3 merupakan rumus empiris, sedangkan senyawa C2H6 merupakan rumus molekul.
Apa yang dimaksud rumus empiris? Apa itu rumus molekul? Bagaimana perbedaan rumus empiris dan molekul dari suatu senyawa? Sobat idschool dapat mencari tahu lebih banyak rumus empiris dan molekul melalui ulasan di bawah.
Table of Contents
- Rumus Empiris
- Rumus Molekul
- Hubungan Rumus Empiris dan Molekul
- Contoh Soal Rumus Empiris dan Molekul (+Pembahasan)
Rumus Empiris
Rumus empiris adalah rumus yang menyatakan perbandingan jumlah unsur-unsur penyusun molekul yang paling sederhana. Di mana perbandingan atom-atom penyusun molekul pada rumus empiris berupa perbandingan bilangan bulat paling sederhana.
Cara mendapatkan rumus empiris dari suatu senyawa dilakukan dengan menentukan perbandingan mol terkecil dari atom-atom penyusun suatu senyawa. Dari perbandingan mol dapat diperoleh perbandingan bilangan bulat terkecil yang mewakili perbandingan unsur atom dalam senyawa.
Sebagai contoh, suatu senyawa memiliki perbandingan atom-atom penysunnya dengan bentuk C : H : O = 1 : 2 : 1. Dari perbandingan tersebut dapat disimpulkan bahwa senyawa tersebut memiliki 1 atom C, 2 atom H, dan 1 atom O. Rumus empiris yang sesuai untuk senyawa tersebut adalah CH2O. Nama yang sesuai untuk seyawa tersebut adalah metanal atau formaldehid.

Perhatikan bagaimana cara menentukan rumus empiris dari suatu senyawa pada soal berikut!
Soal 1:
Diketahui persentase unsur C = 41,82%, unsur H = 6,51%, dan unsur O = 51,67%. Tentukan rumus empiris yang dibentuk unsur-unsur atom tersebut!
Cara menentukan rumus empiris meliputi beberapa langkah berikut.
- Mencari perbandingan massa atau persentase unsur-unsur penyusun senyawa.
- Mencari perbandingan mol.
- Perbandingan mol yang paling sederhana menghasilkan rumus empiris.
Penyelesaian:
Misalkan massa senyawa sebesar 100 gram, maka massa atom karbon (C), hidrogen (H), dan oksigen (O) menjadi seperti berikut.
- Massa atom penyusun senyawa:
Massa Karbon:
m C = 41,82/100 × 100 gr = 41,82 gram
Massa Hidrogen:
m H = 6,51/100 × 100 gr = 6,51 gram
Massa Oksigen:
m O = 51,67/100 × 100 gr = 51,67 gram
Mencari perbandingan mol:
mol C : mol H : mol O
= m C/Ar C : m H/Ar H : m O/Ar O
= 41,82/12 : 6,51/1 : 51,67/16
= 3,485 : 6,510 : 3,229
*keuga nilai dibagi 3,229 untuk mendapatkan bentuk paling sederhana
mol C : mol H : mol O
= 3,485/3,229 : 6,51/3,229 : 3,229/3,229
= 1,07 : 2,01 : 1,00
= 1 : 2 : 1
Perbandingan paling sederhana diperoleh C : H : O = 1 : 2 : 1. Jadi, rumus empiris yang dibentuk oleh unsur-unsur tersebut adalah CH2O.
Baca Juga: Rumus Kimia dari Suatu Senyawa
Rumus Molekul
Rumus molekul adalah rumus sebenarnya yang menyatakan jumlah unsur-unsur yang menyusun suatu molekul. Dalam rumus molekul terdapat perbandingan yang sebenarnya dari unsur-unsur penyusun senyawa.
Dua bentuk rumus kimia memenuhi hubungan persamaan Rumus molekul = (Rumus Empiris)n atau Mr Rumus Molekul sama dengan n × Mr Rumus Empiris (n = bilangan bulat positif). Namun cara menentukan rumus molekul selengkapnya bergantung dari informasi apa yang diberikan pada soal.
Secara umum beberapa langkah yang dilakukan untuk menentukan rumus molekul suatu senyawa meliputi beberapa langkah berikut.
- Mencari perbandingan massa dari atom-atom penyusun senyawa
- Mencari perbandingan mol setiap atom-atom
- Menentukan rumus empiris
- Mencari nilai n melalui persamaan n × Mr Rumus Empiris = Mr Rumus Molekul (Senyawa)
- Menentukan rumus molekul
Sebagai contoh perhatikan bagaimana cara menentukan rumus molekul suatu senyawa pada soal berikut.
Soal 2:
Suatu senyawa mempunyai rumus empiris CH2O mempunyai Mr = 60. Tentukan rumus molekul senyawa tersebut! (Ar C =12, H = 1, O = 16)
Penyelesaian:
Pada soal di atas diketahui Mr senyawa (rumus molekul) = 60 dan rumus empiris dari senyawa yaitu CH2O. Sehingga dapat langsung dilakukan perhitungan nilai n. Cara menentukan nilai n dapat menggunakan persaaman Mr Rumus molekul = n × Mr Rumus Empiris.
Menentukan nila n:
Mr Rumus molekul = n × Mr Rumus empiris
60 = n × Mr (CH2O)
60 = (Ar C + 2 Ar H + Ar O) × n
60 = (12 + 2 × 1 + 16) × n
60 = 30n
n = 60/30 = 2
Diperoleh nilai n = 2 sehingga rumus molekul senyawa tersebut memenuhi persamaan (CH2O)2 = C2H4O2. Jadi, diperoleh rumus molekul untuk senyawa tersebut adalah C2H4O2 atau CH3COOH (asam asetat).
Baca Juga: Hukum Perbandingan Volume – Gay Lusaac
Hubungan Rumus Empiris dan Molekul
Rumus empiris dan molekul memiliki hubungan yang dinyatakan dalam suatu persamaan. Persamaan antara rumus empiris dan molekul menyatakan hubungan banyaknya mol pada rumus molekul suatu senyawa sama dengan n banyak mol pada rumus empiris. Di mana n merupakan suatu bilangan bulat yang merupakan faktor perkalian yang sesuai antara rumus empiris dan molekul.
Hubungan rumus empiris dan molekul dinyatakan dalam persamaan Mr Senyawa atau Mr rumus molekul sama dengan n kali Mr rumus empis. Di mana Mr adalah massa relatif yang diperoleh dari penjumlahan massa atom relatif (Ar) dari atom-atom penyusun suatu senyawa.

Keterangan:
Mr = massa molekul relatif
n = suatu bilangan bulat
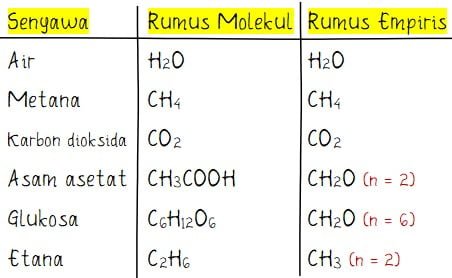
Beberapa senyawa memiliki bentuk rumus empiris dan molekul yang sama. Contoh beberapa senyawa memiliki rumus molekul sama dengan rumus empiris adalah H2O (air), CH4 (metana), CO2 (karbon dioksida), dan lain sebagainya.
Beberapa senyawa lain memiliki bentuk rumus empiris dan molekul yang berbeda. Contoh beberapa senyawa dengan rumus empiris yang berbeda dengan rumus molekul adalah CH3COOH (asam asetat), C6H12O6 (glukosa), C2H6 (etana), dan lain sebagainya. Bentuk rumus empiris dari asam asetat, glukosa, dan etana berturut adalah (CH2O)2, (CH2O)6, dan (CH3)2.
Baca Juga: Cara Menentukan Rumus Molekul Suatu Senyawa
Contoh Soal Rumus Empiris dan Molekul (+Pembahasan)
Sobat idschool dapat menambah pemahaman materi rumus empiris dan molekul melalui beberapa contoh soal di bawah. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan bagaimana hubungan rumus empiris dan molekul. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Rumus Empiris dan Molekul
Kelompok rumus kimia berikut yang semuanya merupakan rumus empiris adalah ….
A. NO2, H2O2, SO2
B. C2H2, C2H4, H2O2
C. C6H6, CH4, C2H4
D. H2O, H2O2, CO2
E. CH3, C2H6O, C2H5
Pembahasan:
Rumus kimia terdiri dari dua jenis yaitu rumus empiris dan molekul. Rumus empiris memiliki karakteristik perbandingan mol dengan bentuk paling sederhana dari setiap unsur penyusunnya. Sedangkan rumus molekul adalah rumus kimia yang sebenanrnya dari suatu senyawa dengan hubungan Mr rumus molekul sama Mr rumus empiris dikali suatu bilangan faktor perkalian.
Sehingga, dapat disimpulkan bahwa rumus empiris terdapat pada senyawa-senyawa dengan perbandingan mol paling sederhana yaitu CH3, C2H6O, C2H5. Jadi, Kelompok rumus kimia berikut yang semuanya merupakan rumus empiris adalah CH3, C2H6O, C2H5.
Jawaban: E
Contoh 2 – Soal Rumus Empiris dan Molekul

Pembahasan:
Berdasarkan informasi yang diberikan pada soal dapat diperoleh keterangan seperti berikut.
- Massa kristal natrium sulfat: m Na2SO4 · xH2O = 23,2 gr
- Massa natrium sulfat yang terbentuk: m Na2SO4 = 14,2 gr
- Reaksi: Na2SO4 · xH2O → Na2SO4 + xH2O
Berdasarkan hukum kekekalan massa (massa zat sebelum dan sesudah reaksi adalah sama) dapat diperoleh massa xH2O setelah reaksi. Sehingga massa xH2O setelah reaksi dapat dihitung melalui cara berikut.

Dari massa Na2SO4 dan H2O selanjutnya dapat diketahui mol dari kedua senyawa tersebut dan mendapatkan perbandingan mol.
- Mol natrium sulfat anhidrat (n1):
n1 = m Na2SO4/Mr Na2CO4
n1 = m Na2SO4/2×Ar Na + Ar C + 4×O
n1 = 14,2/2×23 + 32 + 4×16
n1 = 14,2/142 = 0,10
- Mol air H2O:
n2 = m H2O/Mr H2O
n2 = m H2O/2×Ar H + Ar O
n2 = 9/2×1 + 16
n2 = 9/18 = 0,5
- Perbandingan mol Na2SO4 dan H2O:
n1 : n2 = 0,10 : 0,50
n1 : n2 = 1 : 5
Dari perbandingan mol Na2SO4 : xH2O = 1 : 5 dapat disimpulkan bahwa untuk 1 mol Na2SO4 untuk 5 mol H2O (nilai x = 5). Jadi, rumus molekul senyawa hidrat tersebut adalah Na2SO4 · 5H2O.
Jawaban: D
Contoh 3 – Soal Rumus Empiris dan Molekul
Suatu hidrokarbon mempunyai rumus empiris CH2. Jika Mr senyawa tersebut adalah 28 maka rumus molekulnya adalah …. (Ar C = 12, H = 1)
A. CH2
B. C2H2
C. C2H4
D. C2H6
E. C3H3
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh beberapa informasi seperti berikut.
- Rumus empiris suatu hidrokarbon: CH2
- Massa molekul relatif senyawa: Mr senyawa = 28
- Massa atom relatif karbon: Ar C = 12
- Massa atom relatif hidrogen: Ar H = 1
Menentukan nilai n:
n × Mr CH2 = Mr Senyawa
n × (Ar C + 2 × Ar H) = 28
(12 + 2 × 1)n = 28
14n = 28
n = 28/14 = 2
Mencari rumus molekul:
Rumus molekul = (rumus empiris)2
= (CH2)2
= C2H4
Jadi, jika Mr senyawa tersebut adalah 28 maka rumus molekulnya adalah C2H4.
Jawaban: C
Demikianlah tadi ulasan materi pengertian rumus empiris dan molekul disertai dengan contoh soal beserta pembahasannya. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
