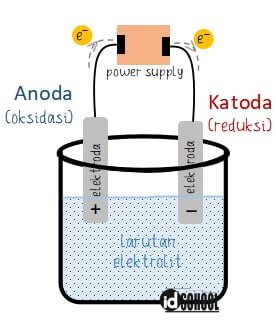
Sel elektrolisis adalah bentuk sel elektrokimia yang mengubah arus listrik ke energi kimia, di mana cara kerjanya memiliki hubungan terbalik dengan sel volta. Pada sel elektrolisis terjadi 2 macam reaksi yaitu reaksi yang terjadi di katoda dan reaksi yang terjadi pada anoda. Sel elektrolisis merupakan sel elektrokimia yang dapat mengubah energi listrik digunakan untuk menghasilkan reaksi redoks tidak spontan.
Prinsip kerja dari sel elektrolisis adalah menghubungkan kutub negatif dari sumber arus listrik ke katoda, sementara kutub positif dihubungkan ke anoda. Kutub negatif dari sumber listrik akan mendorong elektron mengalir ke katoda sehingga katoda bermuatan negatif (‒). Sementara kutub positif dari sumber listrik akan menarik elektron dari anoda sehingga anoda bermuatan positif (+).
Katoda yang bermuatan negatif akan menarik ion-ion positif dalam elektrolit sehingga terjadi reaksi reduksi. Sedangkan anoda yang bermuatan positif akan menarik ion-ion negatif dalam larutan elektrolit sehingga terjadi reaksi oksidasi.
Baca Juga: Reaksi Reduksi‒Oksidasi (Redoks)
Bagaimana cara menentukan reaksi yang terjadi di katoda pada sel elektrolisis? Bagaimana cara menentukan reaksi yang terjadi di anoda pada sel elektrolisis? Sobat idschool dapat mencari tahu jawabannya melalui ulasan cara menentukan reaksi yang terjadi di katoda/anoda pada sel elektrolisis di bawah.
Table of Contents
- Susunan Sel Elektrolisis
- Rekasi yang Terjadi di Elektroda (Katoda/Anoda) pada Sel Elektrolisis
- Contoh Cara Menentukan Reaksi yang Terjadi di Katoda/Anoda pada Sel Elektrolisis
- Contoh Soal dan Pembahasan
Susunan Sel Elektrolisis
Sel elektrolisis secara umum terdiri dari sumber listrik (arus searah/DC), elektroda, dan lelehan/larutan elektrolit.
Elektroda adalah konduktor yang dialiri arus listrik dari satu media ke yang lainnya. Ada 2 jenis elektroda berdasarkan muatan konduktornya yaitu katoda dan anoda. Katoda adalah tempat berkumpulnya kation (ion positif) yang menjadi tempat terjadinya reaksi reduksi. Anoda adalah tempat berkumpulnya anion (ion negatif) yang menjadi tempat terjadinya reaksi oksidasi.
Elektroda ada dua macam berdasarkan bahannya yaitu inert (sangat sukar bereaksi) dan non inert (mudah bereaksi). Elektroda inert meliputi karbon (C), emas (Au), dan platina (Pt). Selain tiga elektorde zat inert tersebut, termasuk elektroda non inert antara lain tembaga (Cu), seng (Zn), besi (Fe), nikel (Ni), dan lain sebagainya.
Elektrolit adalah zat yang dapat menghantarkan listrik yang bentuknya dapat berupa larutan atau lelehan. Bentuk zat elektrolit pada sel elektrolisis mempengaruhi reaksi yang terjadi di katoda/anoda.
Baca Juga: Hubungan Derajat Ionisasi dan Kekuatan Asam/Basa Larutan
Rekasi yang Terjadi di Elektroda (Katoda/Anoda) pada Sel Elektrolisis
Reaksi total sel elektrolisis diperoleh dari reaksi-reaksi yang terjadi pada katoda dan anoda. Reaksi yang terjadi pada katoda/anoda dipengaruhi oleh jenis larutan elektrolit dan elektroda yang digunakan. Ketentuan-ketentuan di bawah memuat bagaimana cara menentukan reaksi yang terjadi di katoda dan anoda pada sel elektrolisis.
Reaksi yang terjadi di Katoda
Rekasi yang terjadi di katoda dilihat dari kation dengan memperhatikan ketentuan-ketentuan berikut.
- Jika kationnya berasal dari golongan IA (Li, Na, K, Rb, Cs, Fr), IIA (Be, Mg, Ca, Sr, Ba, Ra), Al, dan Mn maka reaksi reduksi di katoda adalah reduksi air (H2O):
2H2O (l) + 2e → 2OH‒ (aq) + H2 (g)
- Jika kation berupa H+ dari suatu asam maka akan tererduksi menjadi gas hidrogen:
2H+ (aq) + 2e → H2 (g)
- Jika kationnya selain alkali, alkali tanah, Al3+, dan Mn2+ akan tereduksi menjadi logamnya.
Lx+ (aq) + xe → L (s)
Rekasi yang terjadi di Anoda
Reaksi yang terjadi di anoda dilihat dari elektroda yang digunakan dan anion. Cara menentukan reaksi yang terjadi di anoda pada sel elektrolisis memperhatikan ketentuan-ketentuan berikut.
1) Elektrode non inert (selain Pt, Au, atau C ):
Jika elektrode yang digunakan adalah non inert maka logam elektroda akan mengalami oksidasi menjadi ionnya.
Contoh oksidasi anoda dengen elektroda non inert:
Ag (s) → Ag+ (aq) + e
2Cu (s) → Cu2+ (aq) + 2e
2) Elektrode inert (Pt, Au, atau C ):
Jika anoda terbuat dari zat inert (sukar bereaksi) maka elektrode anoda tidak teroksidasi, namun terjadi reaksi-reaksi yang sesuai dengan anion dengan ketentuan-ketentuan di bawah.
- Jika anion OH‒ dari suatu basa maka teroksidasi menjadi H2O dan gas O2
4OH‒ (aq) → 2H2O (l) + O2 (g) + 4e
- Jika anionnya sisa asam halida (Cl‒, Br‒, dan I‒) maka ion-ion tersebut akan teroksidasi menjadi molekulnya.
Contoh: Cl‒ (aq) → Cl2 (g)
- Ion sisa asam oksi (asam yang mengandung oksigen) misalnya SO42‒, NO3‒, CO32‒ tidak teroksidasi, melaikan H2O yang teroksidasi.
2H2O (l) → 4H+ (aq) + O2 (g) + 4e
Selain larutan elektrolit, bentuk cairan penghantar juga dapat berupa lelehan/leburan (tanpa air) elektrolit. Jika cairan pada sel elektrolisis menggunakan lelehan/leburan elektrolit maka rekasi yang terjadi di katoda/anoda sesuai ketentuan berikut.
- Rekasi pada katoda: dilihat dari kation
Semua jenis kation akan langsung mengalami proses reduksi, contoh Na+ + e → Na.
- Rekasi pada anoda: lihat elektroda dan anion
Elektroda non inert: elektroda akan mengalami proses oksidasi
Contoh: 2Cu (s) → Cu2+ (aq) + 2e
Eelektroda inert: anion akan mengalami proses oksidasi.
Ketentuan:
Anion = ion oksida (O2‒): 2O2‒ (aq) → O2 (g) + 4e
Anion = ion halida (X‒, F‒, Cl‒, Br‒, I‒): 2X‒ → X2 + 2e
Secara ringkas, ketentuan cara menentukan reaksi yang terjadi di katoda dan anoda pada sel elektrolisis sesuai dengan tabel berikut.


Baca Juga: Cara Menentukan Bilangan Oksidasi
Contoh Cara Menentukan Reaksi yang Terjadi di Katoda/Anoda pada Sel Elektrolisis
Sobat idschool dapat mengamati bagaimana cara menentukan reaksi yang terjadi di katoda dan anoda pada sel elektrolisis melalui beberapa contoh berikut.
Soal:
Tentukan reaksi elektrolisis larutan NaNO3 dengan elektroda Pt!
Penyelesaian:

Beberapa contoh cara menentukan reaksi yang terjadi di katoda/anoda pada sel elektrolisis termuat dalam daftar berikut.
- Elektrolisis larutan NaCl dengan elektroda karbon (C)
Ionisasi larutan: NaCl (aq) → Na+ (aq) + Cl‒ (aq)
Katoda (‒): 2H2O (l) + 2e → H2 (g) + 2OH‒ (aq)
Anoda (+): 2Cl‒ (aq) → Cl2 (g) + 2e
Reaksi eletrolisis: 2Cl‒ (aq) + 2H2O (l) → Cl2 (g) + 2e
- Elektrolisis larutan CuCl2 dengan elektroda Besi (Fe)
Ionisasi larutan: CuCl2 (aq) → Cu2+ (aq) + 2Cl‒ (aq)
Katoda (‒): Cu2+ (aq) + 2e → Cu (s)
Anoda (+): Fe (s) → Fe2+ (aq) + 2e
Reaksi eletrolisis: Cu2+ (aq) + Fe (s) → Cu (s) + Fe2+ (aq)
- Elektrolisis lelehan NaCl dengan elektroda karbon (C)
Ionisasi larutan: NaCl (aq) → Na+ (aq) + Cl‒ (aq)
Katoda (‒): Na+ (aq) + e → Na (s)
Anoda (+): 2Cl‒ (aq) → Cl2 (g) + 2e
Reaksi eletrolisis: 2Na+ (aq) + 2Cl‒ (aq) → 2Na (s) + Cl2 (g)
Baca Juga: Rumus Kelarutan (s) dan Hasil Kali Kelarutan (Ksp)
Contoh Soal dan Pembahasan
Beberapa contoh soal reaksi yang terjadi di katoda dan anoda pada sel elektrolisis di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan cara menentukan reaksi yang terjadi di katoda/anoda pada sel elektrolisis. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal reaksi yang terjadi di katoda. Selamat Berlatih!
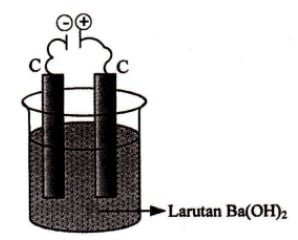
Contoh 1 – Soal Menentukan Reaksi yang Terjadi di Katoda
Perhatikan sel elektrolisis berikut ini!
Reaksi yang terjadi di katoda adalah …
A. Ba2+ (aq) + 2e → Ba (s)
B. 2H2O (l) + 2e → H2 (g) + 2OH‒ (aq)
C. Cu2+ (aq) + 2e → Cu (s)
D. 4OH‒ (aq) → 2H2O (l) + O2 (g) + 4e
E. Cu (s) → Cu2+ (aq) + 2e
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diketahui beberapa informasi seperti berikut.
- Larutan yang digunakan: BaOH2
- Elektroda: C (karbon) → zat inert (sukar bereaksi)
Agar dapat menentukan reaksi pada katoda maka perlu melihat reaksi ionisasi dari larutan BaOH2. Selanjutnya dapat diketahui kation dari larutan yang kemudian dapat digunakan untuk menentukan reaksi yang terjadi pada katoda.
Reaksi ionisasi larutan BaOH2:
Ba(OH)2 (aq) → Ba2+ (aq) + 2OH‒ (aq)
Kation dari larutan adalah Ba2+ yaitu Barium yang berasal dari golongan IIIA. Sehingga, berdasarkan ketentuannya maka reaksi reaksi reduksi di katoda adalah penguraian H2O.

Jadi, reaksi yang terjadi di katoda adalah H2O (l) + 2e → H2 (g) + 2OH– (aq).
Jawaban: B
Contoh 2 – Soal Menentukan Reaksi yang Terjadi di Katoda/Anoda
Pada elektrolisis larutan perak nitrat dengan elektode karbon, reaksi yang terjadi di anode adalah …..
A. Ag+ (aq) + e‒ → Ag (s)
B. 2H2O (aq) + 2e‒ → 2OH‒ (aq) + H2O (g)
C. 2H2O (l) → 4H+ (aq) + O2 (g) + 4e‒
D. Ag (s) → Ag+ (aq) + e‒
E. 2NO3‒ (aq) → 2NO2+ (g) + O2 (g) + 2e‒
Pembahasan:
Rangkaian sel elektolisis menggunakan elektroda inert (sukar bereaksi) yaitu karbon (C) sehingga tidak terjadi reaksi. Selanjutnya, cari tahu bagaimana anion dari larutan perak nitrat.
Rumus senyawa dari perak nitrat adalah AgNO3, ionisasi larutan dari perak nitrat menghasilkan Ag+ (kation) dan NO3‒ (anion).
Ionisasi larutan AgNO3:
AgNO3 (aq) → Ag+ (aq) + NO3‒ (aq)
Anion pada reaksi ionisasi larutan perak nitrat merupakan ion sisa asam oksi (asam yang mengandung oksigen) sehingga tidak mengalami oksidasi. Oksidasi pada anoda yang terjadi reaksi 2H2O (aq) → 4H+ (aq) + O2 (g) + 4e‒.
Anion dari perak nitrat adalah NO3‒ yang merupakan sisa asam oksi. Sehingga, reaksi yang terjadi di anoda adalah reaksi oksidasi air.
Rekasi pada anoda:
2H2O (l) → 4H+ (aq) + O2 (g) + 4e‒
Jadi, jawaban yang benar adalah reaksi yang terjadi di anode adalah 2H2O (l) → 4H+ (aq) + O2 (g) + 4e‒.
Jawaban: C
Contoh 3 – Soal Menentukan Reaksi yang Terjadi di Katoda/Anoda
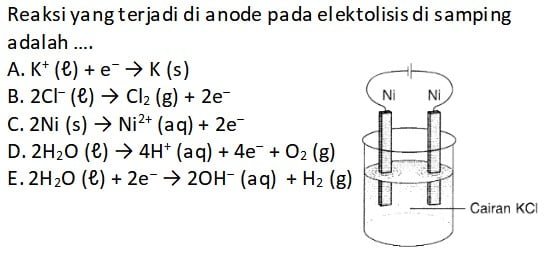
Pembahasan:
Cara menentukan reaksi yang terjadi di anoda bergantung dari elektroda yang digunakan.
- Jika elektroda yang digunakan merupakan zat inert (Pt, Au, C) maka reaksi yang terjadi pada anoda bergantung dari anion larutan.
- Jika elektroda yang digunakan merupakan zat non inert maka reaksi oksidasi terjadi untuk elektroda.
Elektroda yang digunakan pada rangkaian sel elektrolisis pada soal adalah Ni yang merupakan zat non inert. Sehingga reaksi oksidasi yang terjadi pada anoda adalah reaksi elektroda (Ni).
Reaksi pada anoda:
Ni (s) → 2 Ni2+ (aq) + 2e‒
Jadi, reaksi yang terjadi di anode pada elektolisis tersebut adalah 2Ni (s) → Ni2+ (aq) + 2e‒.
Jawaban: C
Demikianlah tadi ulasan cara menentukan reaksi yang terjadi di katoda/anoda pada sel elektrolisis. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Cara Menghitung Perubahan Entalpi dari Suatu Diagram