Diagram sel volta adalah rangkaian sel elektrokimia yang memiliki kemampuan untuk mengubah energi kimia menjadi energi listrik. Sel elektrokimia meliputi dua macam yaitu sel elektrolisis dan sel volta/galvani. Kedua jenis sel elektrokimia tersebut memiliki hubungan yang saling berkebalikan. Contoh penerapan sel volta terdapat pada aki (sel basah) dan baterai alkalin (sel kering).
Energi kimia pada reaksi sel volta berasal dari dua reaksi yaitu reaksi reduksi dan oksidasi (reaksi redoks). Tempat berlangsungnya reaksi redoks berada di elektroda yang terdiri atas katoda (tempat terjadi reduksi) dan anoda (tempat terjadinya oksidasi). Prinsip kerja sel volta dalam menghasilkan arus listrik terjadi melalui aliran transfer elektron dari reaksi oksidasi di anoda ke reaksi reduksi di katoda melalui rangkaian luar. Sehingga dapat dikatakan bahwa aliran elektron pada sel volta terjadi dari logam anoda sebagai kutub negatif (‒) ke logam katoda sebagai kutub positif (+).
Potensial listrik yang dihasilkan melalui diagram sel volta disebut dengan potensial sel (Eo) yang besarnya dapat dihitung melalui rumus potensial sel.
Apa rumus untuk menghitung potensial sel? Bagaimana susunan sel volta? Bagaimana penulisan notasi atau diagram sel volta? Sobat idschool dapat mencari tahu jawabannya melalui ulasan diagram sel volta di bawah.
Table of Contents
- Struktur/Susunan Diagram Sel Volta
- Rumus Potensial Sel (Eo)
- Penulisan Notasi Sel Volta
- Contoh Soal dan Pembahasan
Struktur/Susunan Diagram Sel Volta
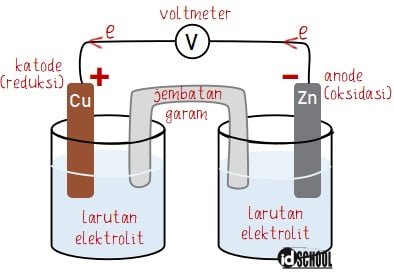
Secara umum diagram sel volta terdiri dari elektroda (anoda dan katoda), larutan elektrolit, rangkaian listrik bagian luar, dan jembatan garam.
- Elektroda:
Anoda = elektrode tempat terjadinya reaksi oksidasi (kutub negatif)
Katoda = elektrode tempat terjadinya reaksi reduksi (kutub positif) - Larutan elektrolit: zat yang dapat menghantarkan listrik, contohnya adalah ZnSO4 dan CuSO4
- Rangkaian luar: kawat konduktor yang menghubungkan anode dengan katode
- Jembatan garam: pipa berbentuk U yang berisi elektrolit dalam bentuk gel seperti NaNO3/KNO3/NaCl untuk menetralkan kelebihan muatan positif (di anoda) dan muatan negatif (di katoda).
Contoh diagram sel volta terdapat pada rangkaian yang terdiri dari logam Zn dicelupkan dalam larutan ion Zn2+ (missal: ZnSO4/seng sulfat) dan logam Cu dicelupkan dalam larutan ion Cu2+ (missal CuSO4/tembaga (II) sulfat).
Pada contoh rangkaian tersebut, elektroda yang mengalami oksidasi adalah Zn dan elektroda yang mengalami reduksi adalah Cu. Sehingga dapat ditentukan bahwa anoda dan katoda pada rangkaian sel vota berturut-turut adalah Zn dan Cu.
Gambaran rangkaian diagram sel volta yang sesuai dengan kondisi di atas sesuai dengan bagan berikut.
Baca Juga: Cara Menghitung Laju Reaksi Kimia dan Faktor-Faktor yang Mempengaruhinya
Rumus Potensial Sel (Eo)
Besar potensial sel pada suatu diagram sel volta dapat ditentukan melalui suatu percobaan/eksperimen menggunakan voltmeter atau dihitung berdasarkan data potensial reduksi standar. Pada sel volta, reaksi berlangsung spontan ketika nilai potensial sel bernilai positif (Eo).
Logam yang mengalami reduksi pada rangkaian diagram sel volta umumnya memiliki potensial sel lebih besar. Atau dapat dikatakan bahwa potensial sel katoda (Eo katoda) lebih besar dari potensial sel anoda (Eo anoda).
Potensial sel standar dapat dihitung dengan penjumlahan rumus Eo sel = Eo oksidasi + Eo reduksi. Karena setengah reaksi oksidasi memiliki tanda yang berlawanan, maka potensial sel menjadi Eo sel = Eo reduksi ‒ Eo oksidasi = Eo katoda ‒ Eo anoda. Satuan untuk potensial sel sama dengan satuan tegangan listrik yaitu volt (V).
Nilai potensial sel dapat digunakan untuk menentukan berlangsungnya atau tidaknya suatu reaksi redoks. Jika potensial sel hasil perhitungan bertanda positif maka reaksi berlangsung (spontan). Jika potensial sel hasil perhitungan bertanda negatif maka reaksi tidak berlangsung (tidak spontan).
Contoh hasil nilai potensial sel untuk mengetahui berlangsung atau tidaknya suatu reaksi redoks ditunjukkan seperti pada persoalan berikut.
Soal:
Diketahui data potensial elektroda standar untuk Zn dan Ag sebagai berikut:
Zn2+ (aq) + 2e → Zn (s) E° = ‒0,76 volt
Ag+ (aq) + e → Ag (s) E° = +0,80 volt
Tanya:
Apakah reaksi AgSO4 + Zn → Ag + ZnSO4 berikut dapat berlangsung?
Penyelesaian:
Dari dara potensial elektroda standar yang diberikan dapat diketahui bahwa E°Ag lebih besar dari E°Zn. Sehingga dapat disimpulkan bahwa katoda = Ag dan anoda = Zn.
Menghitung potensial sel:
Eosel = Eo katoda – Eo anoda
Eosel = 0,80 – (–0,76) = 0,80 + 0,76 = +1,56 volt
Diperoleh hasil hitung Eo bernilai positif (Eo > 0), sehingga dapat disimpulkan bahwa reaksi AgSO4 + Zn → Ag + ZnSO4 berlangsung spontan.
Baca Juga: Persamaan Laju Reaksi dan Cara Menentukan Besar Orde Reaksi
Penulisan Notasi Sel Volta
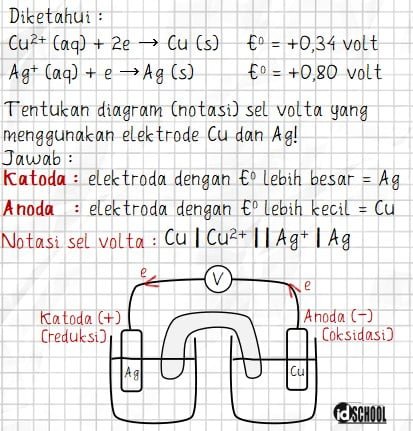
Notasi atau diagram sel volta memuat informasi mengenai reaksi yang terjadi pada anoda dan katoda. Reaksi oksidasi pada anoda dituliskan di sebelah kiri, sedangkan reaksi reduksi pada katoda dituliskan di sebelah kanan.
Setiap rekasi pada anoda atau katoda memuat ion dan logam. Pada anoda, logam dituliskan terlebih dahulu yang diikuti oleh ion dengan dipisahkan sebuah garis lurus. Sedangkan pada katoda, ion dituliskan terlebih dahulu kemudian diikuti logam yang diantaranya dipisahkan oleh sebuah garis lurus.
Antara reaksi yang terjadi anoda dan katoda dipisahkan oleh tanda dua garis lurus. Penulisan notasi sel volta sesuai dengan bentuk berikut.
Contoh cara penulisan digram sel volta ditunjukkan seperti pada penyelesian soal berikut.
Soal:
Diketahui data potensial elektroda standar untuk Zn dan Ag sebagai berikut:
Zn2+ (aq) + 2e → Zn (s) E° = ‒0,76 volt
Ag+ (aq) + e → Ag (s) E° = +0,80 volt
Penyelesaian:
Dari data yang diberikan dapat diketahui bahwa katoda = Ag dan anoda = Zn karena potensial sel elektroda Ag lebih besar dari Zn.
Sehingga, notasi sel volta pada soal dapat dituliskan seperti berikut.

Baca Juga: Rumus q Reaksi dan Hubungannya dengan Perubahan Entalpi
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan notasi/diagram sel volta di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan diagram sel volta. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Notasi/Digaram Sel Volta
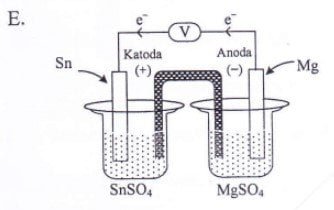
Diketahui notasi sel volta: Mg | Mg2+ || Sn2+ | Sn E = 2,23 volt. Gambar sel volta berdasarkan notasi sel tersebut adalah ….


Pembahasan:
Dari soal dapat diperoleh informasi notasi sel volta: Mg | Mg2+ || Sn2+ | Sn E = +2,23 volt. Dari notasi sel tersebut dapat diketahui bahwa elektroda yang menjadi anoda (‒) = Mg dan katoda (+) = Sn. Di mana aliran elektron pada sel volta terjadi dari anoda menuju ke katoda.
Gambar sel volta yang terdiri dari Mg sebagai anoda (‒), Sn sebagai katoda (+), dan aliran elektron dari anoda ke katoda terdapat pada pilihan A.
Jawaban: A
Contoh 2 – Soal Diagram Sel Volta
Diketahui harga potensial sel dari:
2H+ + 2e → H2 Eo = 0 volt
Al3+ + 3e → Al Eo = ‒1,66 volt
Zn2+ + 2e → Zn Eo = ‒0,76 volt
Mg2+ + 2e → Mg Eo = ‒2,37 volt
Cu2+ + 2e → Cu Eo = +0,34 volt
Notasi sel yang berlangsung spontan adalah ….
A. Cu/Cu2+//H+/H2
B. Mg/Mg2+//Cu2+/Cu
C. Ag/Ag2+//Al3+/Al
D. H2/2H+//Al3+/Al
E. Zn/Zn2+//Mg2+/Mg
Pembahasan:
Notasi sel yang berlangsung spontan terdapat pada sel volta yang ditandai dengan nilai Eo reaksi bernilai positif (+). Dari data dan beberapa pilihan yang diberikan berupa diagram sel volta akan diselidiki mana diagram sel volta yang memiliki nilai potensial listrik positif.
A. Cu/Cu2+ [anoda] // H+/H2 [katoda]
Eosel = Eokatoda ‒ Eoanoda
Eosel = 0 ‒ (+0,34) = ‒0,34
B. Mg/Mg2+//Cu2+/Cu
Eosel = Eokatoda ‒ Eoanoda
Eosel = +0,34 ‒ (‒2,37) = +2,71
C. Ag/Ag2+//Al3+/Al
Eosel = Eokatoda ‒ Eoanoda
Eosel = ‒1,66 ‒ (+0,80) = ‒2,46
D. H2/2H+//Al3+/Al
Eosel = Eokatoda ‒ Eoanoda
Eosel = ‒1,66 ‒ 0 = ‒1,66
E. Zn/Zn2+//Mg2+/Mg
Eosel = EoMg ‒ EoZn
Eosel = ‒2,37 ‒ (‒0,76) = ‒1,61
Dari hasil perhitung dapat diketahui bahwa potensial sel (Eo) yang memiliki nilai positif terdapat pada sel volta Mg/Mg2+//Cu2+/Cu. Jadi, notasi sel yang berlagsung spontan adalah Mg/Mg2+//Cu2+/Cu.
Jawaban: B
Baca Juga: Cara Menentukan Reaksi yang Terjadi di Anoda/Katoda pada Sel Elektrolisis
Contoh 3 – Soal Diagram Sel Volta
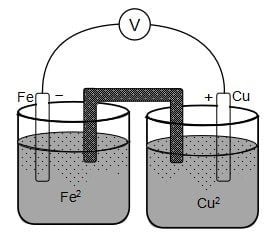
Perhatikan gambar sel volta berikut!
Diketahui harga potensial reduksi berikut.
Cu2+ (aq) + 2e‒ → Cu (s) Eo = +0,34 V
Fe2+ (aq) + 2e‒ → Fe (s) Eo = ‒0,44 V
Pernyataan yang benar mengenai sel volta tersebut adalah ….
A. Reaksi yang terjadi di anode: Cu (s) → Cu2+ (aq) + 2e‒
B. Elektrode Fe sebagai katode dan Cu sebagai anode
C. Elektron mengalir dari elektrode Cu menuju Fe
D. Reaksi yang terjadi berlangsung spontan
E. Potensial selnya sebesar +0,10 V
Pembahasan:
Pada sel volta, elektroda dengan kutub positif adalah katoda dan elektroda dengan kutub negatif adalah anoda. Sehingga dapat disimpulkan bahwa sel volta pada soal yang diberikan memilki katoda = Cu dan anoda = Fe (pilihan B tidak tepat). Diketahui bahwa aliran elektron terjadi dari anoda ke katoda dari Fe ke Cu (pilihan C tidak tepat).
Rekasi yang terjadi pada anoda adalah reaksi oksidasi, sedangkan reaksi yang terjadi pada katoda adalah reaksi reduksi. Sehingga reaksi sel vota yang sesuai dengan gambar dinyatakan seperti berikut.
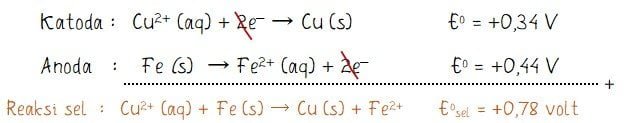
Dari hasil perhitungan dipeorleh bahwa nilai potensial sel Eo = +0,78 volt di mana nilai Eo > 0 yang menunjukkan bahwa reaksi berlangsung spontan.
Jadi, pernyataan yang benar mengenai sel volta tersebut adalah reaksi yang terjadi berlangsung spontan.
Jawaban: D
Demikianlah tadi ulasan diagram sel volta yang meliputi struktur sel volta rumus Eo sel, cara penulisan notasi/diagram sel volta, serta beberapa contoh soal diagram sel volta dalam ujian. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!