Sifat periodik unsur merupakan sifat unsur yang berhubungan dengan letak unsur dalam tabel periodik (periode dan golongan). Beberapa sifat periodik unsur yang dibahas meliputi jari-jari atom, energi ionisasi, keelektronegatifan, afinitas elektron, sifat logam, dan titik leleh serta titik didih. Sifat keperiodikan unsur adalah sifat-sifat yang berubah secara beraturan sesuai dengan kenaikan nomor atom unsur.
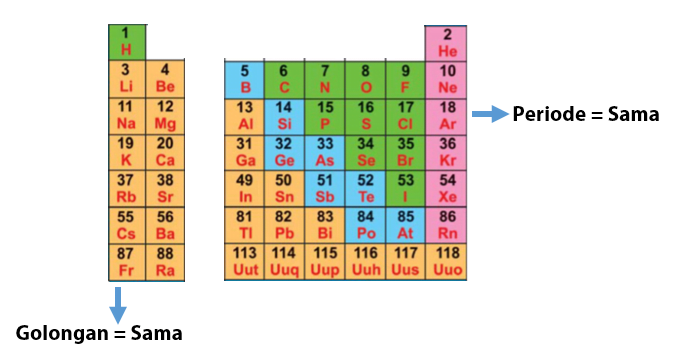
Apakah terdapat kecenderungan sifat periodik unsur untuk setiap golongan atau periode? Sebelumnya, sedikit mengingat susunan atom dalam tabel sistem periodik unsur yang disusun dalam periode dan golongan. Susunan unsur dalam satu barisan vertikal termasuk dalam golongan yang sama. Sedangkan susunan unsur dalam satu barisan horizontal memiliki periode yang sama.
Baca Juga: Struktur Atom (Proton – Neutron – Elektron)
Simak ulasan lebih lanjut mengenai sifat periodik unsur dengan bahasan meliputi jari – jari atom, energi ionisasi, keelektronegatifan, afinitas elektron, sifat logam, dan titik leleh serta titik didih pada masing – masing ulasan di bawah.
Table of Contents
- Sifat Periodik Unsur: Jari – Jari Atom
- Sifat Periodik Unsur: Energi Ionisasi
- Sifat Periodik Unsur: Afinitas Elektron
- Sifat Periodik Unsur: Keelektronegatifan
- Sifat Periodik Unsur: Sifat Logam
- Sifat Periodik Unsur: Titik Leleh dan Titik Didih
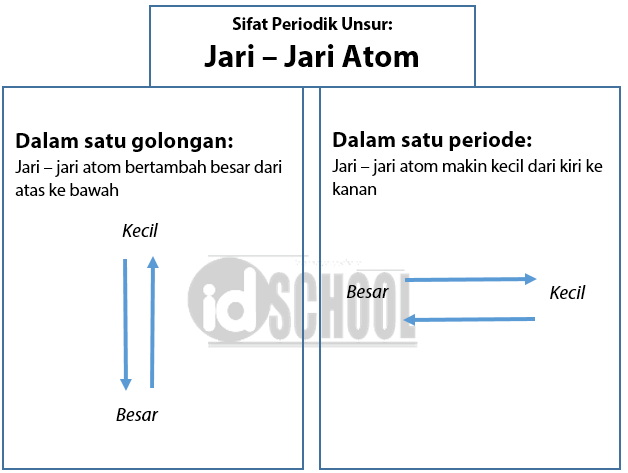
Sifat Periodik Unsur: Jari – Jari Atom
Jari – jari atom adalah jarak dari inti atom sampai kulit terluar. Dalam satu golongan, konfigurasi unsur – unsur satu golongan mempunyai jumlah elektron valensi sama dan jumlah kulit bertambah. Akibatnya, jarak elektron valensi dengan inti semakin jauh. Sehingga, jari – jari atom dalam satu golongan makin ke bawah semakin besar.
Unsur – unsur yang seperiode memiliki jumlah kulit yang sama. Akan tetapi, tidaklah berarti mereka memiliki jari-jari atom yang sama pula. Semakin ke kanan letak unsur, proton dan elektron yang dimiliki makin banyak, sehingga tarik-menarik inti dengan elektron makin kuat. Akibatnya, elektron – elektron terluar tertarik lebih dekat ke arah inti. Jadi, dalam unsur – unsur yang terletak dalam satu periode memiliki nilai jari-jari atom makin ke kanan semakin kecil.
Sifat Periodik Unsur: Energi Ionisasi
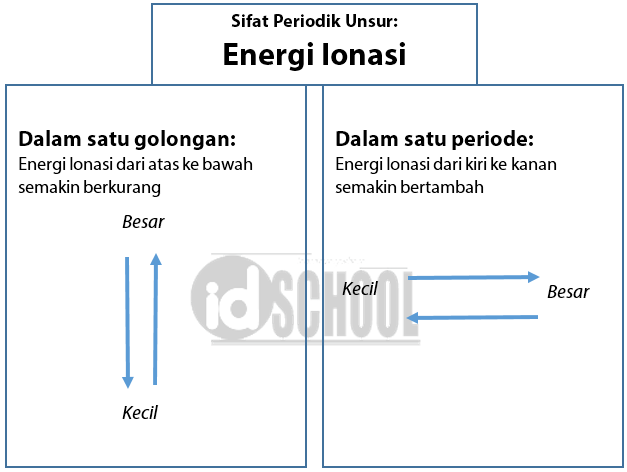
Energi ionisasi adalah energi minimum yang diperlukan untuk melepaskan elektron dari suatu atom netral dalam wujud gas. Energi yang diperlukan untuk melepaskan elektron kedua disebut energi ionisasi kedua dan seterusnya. Bila tidak ada keterangan khusus maka yang disebut energi ionisasi adalah energi ionisasi pertama.
Unsur – unsur yang terletak pada satu golongan memiliki nilai jari – jari atom dari atas ke bawah yang bertambah. Sehingga, daya tarik inti terhadap elektron terluar semakin kecil. Elektron semakin mudah dilepas dan energi yang diperlukan untuk melepaskannya makin kecil. Kesimpulannya, dalam satu golongan dari atas ke bawah energi ionisasi semakin berkurang.
Unsur – unsur dalam satu periode dari kiri ke kanan memiliki daya tarik inti terhadap elektron semakin besar sehingga elektron semakin sukar dilepas. Energi yang diperlukan untuk melepaskan elektron tentunya semakin besar. Sehingga, dalam satu periode dari kiri ke kanan energi ionisasi cenderung bertambah.
Sifat Periodik Unsur: Afinitas Elektron
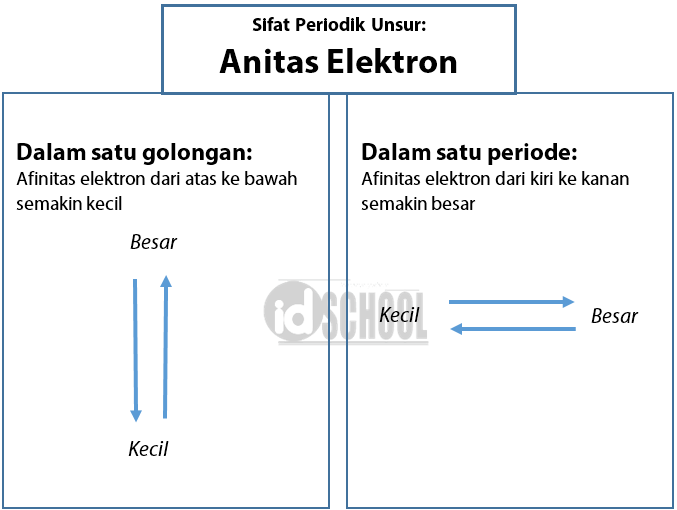
Afinitas elektron adalah besarnya energi yang dibebaskan satu atom netral dalam wujud gas pada waktu menerima satu elektron sehingga terbentuk ion negatif.
Apabila ion negatif yang terbentuk stabil, energi dibebaskan dinyatakan dengan tanda negatif ( – ). Apabila ion negatif yang terbentuk tidak stabil, energi diperlukan/diserap dinyatakan dengan tanda positif (+).
Unsur – unsur halogen (Golongan VII A) mempunyai afinitas elektron paling besar/paling negatif yang berarti paling mudah menerima elektron. Kecenderungan afinitas elektron menunjukkan pola yang sama dengan pola kecenderungan energi ionisasi.
Dalam satu golongan: nilai afinitas elektron dari atas ke bawah semakin kecil.
Dalam satu periode: nilai afinitas elektron dari kiri ke kanan semakin besar.
Sifat Periodik Unsur: Keelektronegatifan
Keelektronegatifan adalah bilangan yang menyatakan kecenderungan suatu unsur menarik elektron dalam suatu molekul senyawa.
Energi ionisasi dan afinitas elektron berkaitan dengan besarnya daya tarik elektron. Semakin besar daya tarik elektron semakin besar energi ionisasi, juga semakin besar (semakin negatif) afinitas elektron. Jadi, suatu unsur yang mempunyai energi ionisasi dan afinitas elektron yang besar akan mempunyai keelektronegatifan yang besar.
Semakin besar keelektronegatifan, unsur cenderung makin mudah membentuk ion negatif. Semakin kecil keelektronegatifan, unsur cenderung makin sulit membentuk ion negatif dan cenderung semakin mudah membentuk ion positif.
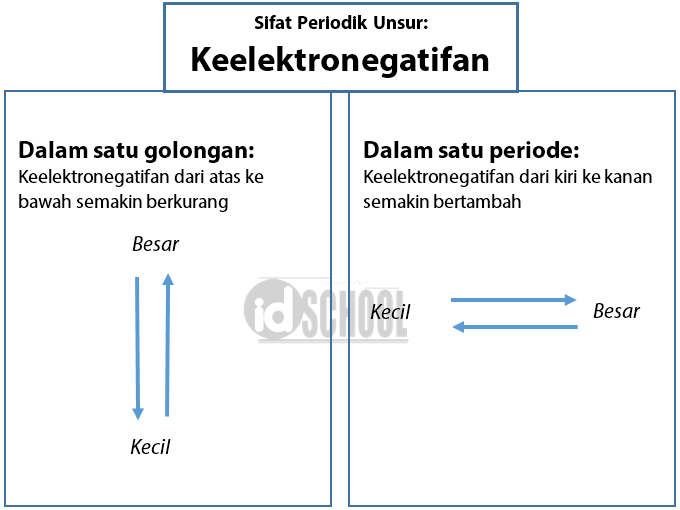
Dalam satu golongan: nilai keelektronegatifan dari atas ke bawah semakin berkurang.
Dalam satu periode: nilai keelektronegatifan dari kiri ke kanan semakin bertambah.
Sifat Periodik Unsur: Sifat Logam
Secara kimia, sifat logam dikaitkan dengan keelektronegatifan. Sifat logam menyatakan kecenderungan melepas elektron membentuk ion positif. Dapat juga dikatakan sebagai sifat logam tergantung pada energi ionisasi.
Ditinjau dari konfigurasi elektron, unsur – unsur logam cenderung melepaskan elektron (memiliki energi ionisasi yang kecil), sedangkan unsur-unsur bukan logam cenderung menangkap elektron (memiliki keelektronegatifan yang besar).
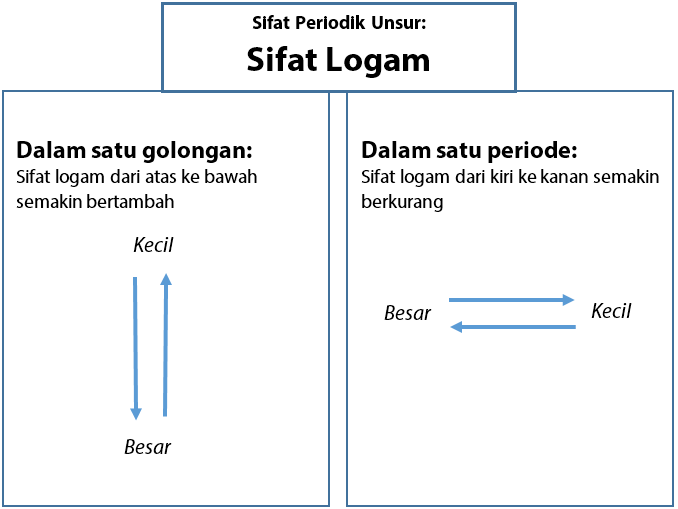
Dalam satu golongan: sifat logam dari atas ke bawah bertambah, sedangkan sifat non logam berkurang.
Dalam satu periode: sifat logam dari kiri ke kanan berkurang, sedangkan sifat non logam bertambah.
Baca Juga: Konfigurasi Elektron (Model Bohr dan Model Mekanika Kuantum)
Penjelasan ini menerangkan letak unsur – unsur logam yang berada pada bagian kiri – bawah sistem periodik unsur, sedangkan unsur-unsur nonlogam terletak pada bagian kanan – atas.
Batas logam dan nonlogam pada sistem periodik sering digambarkan dengan tangga diagonal bergaris tebal, sehingga unsur – unsur di sekitar daerah perbatasan antara logam dan nonlogam itu mempunyai sifat logam sekaligus sifat nonlogam. Unsur-unsur itu disebut unsur metaloid, contohnya adalah boron dan silikon.
Selain itu, sifat logam juga berhubungan dengan kereaktifan (mudah bereaksi) suatu unsur. Unsur – unsur logam pada sistem periodik unsur makin ke bawah semakin reaktif (makin mudah bereaksi) karena semakin mudah melepaskan elektron. Sebaliknya, unsur-unsur bukan logam pada sistem periodik makin ke bawah makin kurang reaktif (makin sukar bereaksi) karena semakin sukar menangkap elektron.
Kesimpulannya, unsur logam yang paling reaktif adalah golongan IA (logam alkali) dan unsur non logam yang paling reaktif adalah golongan VIIA (halogen).
Sifat Periodik Unsur: Titik Leleh dan Titik Didih
Dalam satu golongan terdapat ada dua jenis kecenderungan:
- Unsur – unsur golongan IA – IVA: titik cair dan titik didih makin rendah dari atas ke bawah
- Unsur-unsur golongan VA – VIIIA: titik cair dan titik didihnya makin tinggi.
Dalam satu periode: titik cair dan titik didih naik dari kiri ke kanan sampai golongan IVA, kemudian turun drastis. Titik cair dan titik didih terendah dimiliki oleh unsur golongan VIIIA.
Demikianlah ulasan materi terkait sifat periodik unsur yang meliputi sifat periodik unsur untuk jari – jari atom, energi ionasi, afinitas elektron, keelektronegatifan, sifat logam, dan titik leleh – titik didih. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
