Konfigurasi elektron menunjukkan susunan elektron-elektron pada sebuah atom. Melalui konfigurasi elektron, sobat idschool dapat mengetahui jumlah elektron pada setiap kulit atom, serta dapat juga untuk mengetahui letak golongan dan periode dari suatu atom. Ada dua cara yang dapat digunakan untuk melakukan konfigurasi elektron. Cara pertama adalah konfigurasi elektron model Bohr, dan cara kedua adalah cara konfigurasi elektron model mekanika kuantum.
Untuk melakukan konfigurasi elektron suatu atom, sobat idschool perlu mengetahui jumlah elektron suatu atom yang ditunjukkan melalui nomor atom. Konfigurasi elektron model Bohr biasanya dikenalkan pada Sekolah Menengah Atas kelas X, sedangkan untuk model mekanika kuantum diberikan pada tingkat lanjutnya yaitu kelas XI. Sobat idschool bisa mempelajari sesuai kebutuhan sobat idschool.
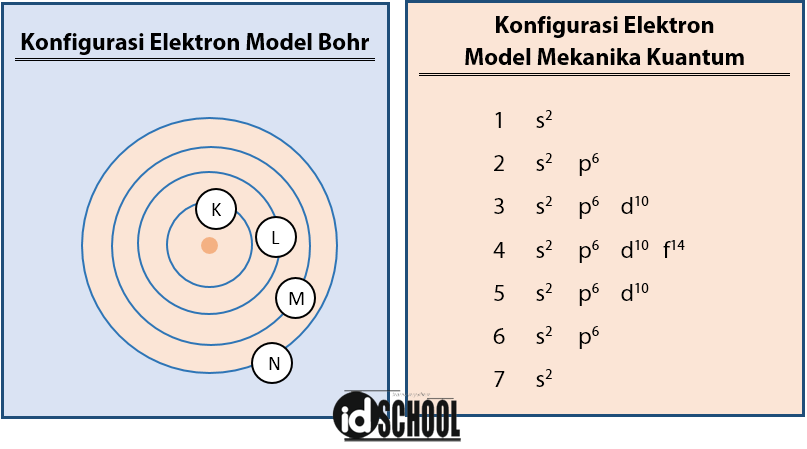
Model Bohr terlihat lebih sederhana dari pada model mekanika kuantum, namun konfigurasi elektron model Bohr memiliki kekurangan yang dilengkapi pada cara konfigurasi elektron model mekanika kuantum.
Bagaimana cara melakukan konfigurasi elektron model Bohr? Bagaimana cara konfigurasi elektron model mekanika kuantum? Simak penjelasan lebih lengkapnya pada masing-masing ulasan di bawah.
Table of Contents
Konfigurasi Elektron Bohr
Model atom yang dijelaskan Niels Bohr mengatakan atom terdiri atas inti atom yang bermuatan positif dan dikelilingi oleh elektron-elektron pada suatu lintasan yang disebut sebagai kulit atom.
Cara melakukan konfigurasi elektron Bohr dilakukan dengan pengisian elektron yang dimulai dari tingkat energi yang paling rendah ke paling tinggi. Energi paling rendah terdapat di kulit K (kulit pertama, n = 1) yang terus meningkat ke kulit L, M, N, dan seterusnya.
Banyaknya elektron yang mengisi masing-masing kulit atom dinyatakan melalui rumus 2n2, sehingga banyak elektron untuk kulit K, L, M, N sesuai dengan daftar berikut.
- K (n = 1) → banyak elektron maksimal = 2
- L (n = 2) → banyak elektron maksimal = 8
- M (n = 3) → banyak elektron maksimal = 18
- N (n = 4) → banyak elektron maksimal = 32
Baca Juga: Perkembangan Teori Atom

Cara melakukan konfigurasi elektron model Bohr dilakukan dengan pengisian elektron dari kulit K ke lulit L, M, N, dan selanjutnya sampai elektron habis dan menempati tempatnya.
Sebagai contoh:
Diketahui atom Li memilki nomor atom 3 sehingga dapat diperoleh jumlah elektron = nomor atom = 3. Pertama, elektron memenuhi kulit K yang maksimum dapat memuat 2 elektron. Kemudian sisa elektron menempati kulit atom berikutnya yaitu kulit L, sebanyak 1 elektron. Sehingga konfigurasi elektron atom 3Li = 2, 1.

Contoh konfigurasi elektron Bohr untuk beberapa atom diberikan seperti tabel di bawah.

Baca Juga: Struktur Atom – Proton Neutron Elektron
Konfigurasi Elektron Model Mekanika Kuantum
Model Bohr masih memiliki kekurangan yaitu tidak dapat digunakan untuk menentukan golongan A dan golongan B dari suatu atom. Sehingga, model konfigurasi untuk elektron-elektron dari suatu atom disempurnakan melalui model mekanika kuantum.
Menurut model atom mekanika kuantum, elektron-elektron dalam atom bergerak mengelilingi inti pada tingkat-tingkat energi tertentu (kulit atom). Pada setiap kulit atom terdiri atas subkulit yang merupakan kumpulan orbital (tempat kemungkinan adanya elektron). Letak elektron menurut model mekanika kuantum dapat dinyatakan melalui empat bilangan kuantum.
Keempat bilangan kuantum menjelaskan letak elektron-elektron suatu atom yang terdiri dari bilangan kuantum utama (n), azimuth (l), magnetik (m), dan spin (s).
Bilangan Kuantum Utama (n): menyatakan tingkat energi utama dengan nilai n = 1, 2, 3, 4, 5, 6, dan 7.
- n = 1 menyatakakan kulit pertama (K)
- n = 2 menyatakakan kulit pertama (L)
- n = 3 menyatakakan kulit pertama (M)
- dan seterusnya
Bilangan kuantum Azimuth (l): menyatakan bentuk orbital tempat elektron berada pada subkulit. Nilai bilangan azimut dimulai dari l = 0, 1, 2, 3, dan seterusnya.
- Nilai l = 0 menyatakan subkulit s
- Nilai l = 1 menyatakan subkulit p
- Nilai l = 2 menyatakan subkulit d
- Nilai l = 3 menyatakan subkulit f
Bilangan Kuantum Magnetik (m): menyatakan letak elektron pada suatu orbital. Nilai bilangan kuantum m adalah …, – 1, 0, +1, …
- Untuk m = 0, subkulit s, m = 0 (terdapat 1 orbital)
- Untuk m = 1, subkulit p, m = – 1, 0, + 1 (terdapat 3 orbital)
- Untuk m = 2, subkulit d, m = –2, – 1, 0, + 1, +2 (terdapat 5 orbital)
- Untuk m = 3, subkulit f, m = –3, –2, – 1, 0, + 1, +2, + 3 (terdapat 7 orbital)
Bilangan Kuantum Spin (s): menyatakan arah perputaran elektron denan nilai bilangan kuantum s adalah ‒1/2 dan 1/2.
- s = +1/2menyatakan arah putaran searah jarum jam dan digambarkan dengan tanda panah ke atas.
- s = –1/2 menyatakan arah putaran berlawanan arah jarum jam digambarkan dengan tanda panah ke arah bawah.
Bilangan kuantum yang biasa dicari adalah bilangan kuantum dari elektron dengan tingkat energi paling tinggi atau elektron paling akhir.
Contoh pada atom Oksigen (nomor atom 8) dengan konfigurasi elektron 8O = 1s2 2s2 2p4. Sehingga, elektron dengan tingkat paling tinggi berada pada orbital 2p4. Nilai masing-masing bilangan kuantum dari 2p4 adalah n = 2, l = 1, m = –1, dan s = ‒1/2.
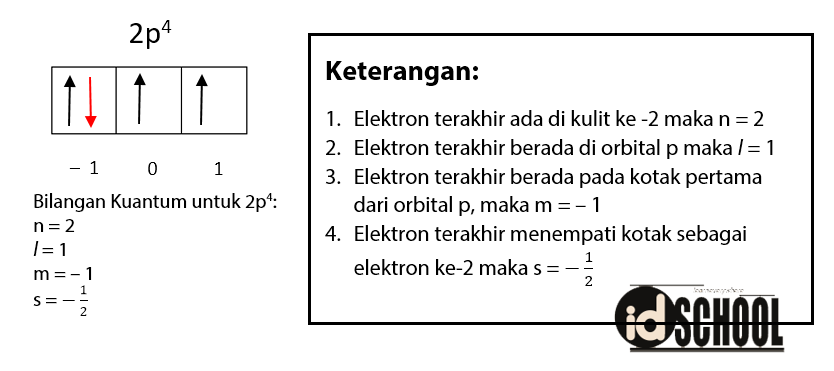
Baca Juga: Cara Menentukan 4 Harga Bilangan Kuantum
Pada konfigurasi elektron model mekanika kuantum perlu mengikuti 4 aturan yang meliputi asas Aufbau, aturan Hund, Larangan Pauli, dan aturan penuh/setengah penuh
1) Asas Aufbau: pengisian elektron dimulai dari tingkat energi terendah ke tingkat energi yang lebih tinggi dengan urutan 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 7s 5f 6d 7p. Urutan kenaikan energi tersebut sesuai dengan bagan berikut.
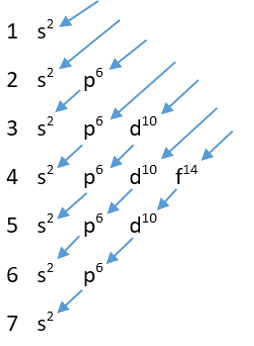
Anak panah menunjukkan urutan pengisian elektron pada model mekanika kuantum. Pengisian pertama diawali oleh 1s2 dan urutan paling akhir oleh 7s 2. Urutan pengisian elektron pada konfigurasi elektron mekanika kuantum lebih lengkapnya adalah 1s2, 2s2, 2p6, 3s2, 3p6, 4s2, 3d10, 4p6 , 5s2, 4d10, 5p6, 6s2, 4f14, 5d10, 6p6, dan 7s2.
2) Kaidah Hund:
keadaan atom paling stabil terjadi bila elektron-elektron tersebut tersebar ke semua orbital dengan spin yang sejajar (spin sama). Dengan kata lain, pengisian elektron tidak akan berpasangan sebelum orbital-orbital dalam satu sub kulit sudah terisi oleh masing-masing 1 elektron.

3) Larangan Pauli: menyatakan tidak ada dua elektron dalam satu orbital yang memiliki keempat bilangan kuantum yang sama. Atau, setiap elektron dari suatu atom atau molekul selalu memiliki empat bilangan kuantum yang berbeda.
Misalnya pada atom Hidrogen (H) dengan nomor atom Z = 1 dan Helium (He) dengan nomor atom Z = 2. Letak elektron untuk kedua atom tersebut berada dalam orbital 1 s yang menunjukkan bahwa kedua atom memiliki tiga bilangan kuantum yang sama yaitu n = 1. l = 0, dan m = 0. Namun dua atom tersebut memiliki bilangan kuantum spin yang berbeda yaitu s = 1/2 (untuk atom H) dan s = ‒1/2 (untuk atom He).
Singkatnya, meskipun dua atom dapat memiliki tiga bilangan kuantum yang sama namun akan selalu berbeda pada bilangan kuantum spin (s).
Baca Juga: Isotop Isobar Isoton
4) Aturan Penuh/Setengah Penuh:
Aturan penuh-setengah penuh terjadi pada atom dengan golongan B yaitu pada pengisian elektron pada subkulit d. Elektron yang berisi penuh d10 dan setengah penuh d5 akan relatif lebih stabil.
Untuk menambah pemahaman sobat idschool dalam memahami materi konfigurasi elektron model mekanika kuantum, perhatikan contoh konfigurasi elektron beberapa atom dengan model mekanika kuantum berikut.
Contoh konfigurasi elektron mekanika kuantum untuk beberapa atom:
- Magnesium (Mg) dengan nomor atom 12: 12Mg = 1s2 2s2 2p6 3s2
- Kalsium (Ca) dengan nomor atom 20: 20Ca = 1s2 2s2 2p6 3s2 3p6 4s2
- Kripton (Kr) dengan nomor atom 36: 36Kr = 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6
- Besi (Fe) dengan nomor atom 26: 26Fe = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Besi yang melepaskan 2 elektron: 26Fe2+ = 1s2 2s2 2p6 3s2 3p6 3d6 - Nikel (Ni) dengan nomor atom 28: 28Ni = 1s2 2s2 2p6 3s2 3p6 4s2 3d8
Demikianlah tadi ulasan materi konfigurasi elektron yang meliputi model Bohr dan model mekanika kuantum. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Cara Menentukan Jumlah Proton Neutron dan Elektron

Sangat bermanfaat