Aturan konfigurasi elektron s p d f atau aturan konfigurasi elektron pada teori atom mekanika kuantum mengikuti 4 aturan. Empat aturan konfigurasi elektron s p d f terdiri dari Prinsip Aufbau, Aturan Hund, larangan Pauli, serta aturan penuh-setengah penuh. Empat aturan tersebut menjelaskan bagaimana cara elektron menempati kedudukan atau posisinya.
Teori atom mekanika kuantum menyatakan bahwa elektron suatu atom menempati orbital yaitu daerah kebolehjadian ditemukan elektron. Jumlah dan bentuk orbital pada setiap sub kulit s, p, d, dan f berbeda-beda. Jumlah orbital pada sub kulit s, p, d, dan f berturut-turut adalah 1, 3, 5, dan 7.

Setiap satu orbital dapat memuat paling banyak dua leketron. Sehingga, banyak elektron maksimal yang menempati sub kulit s, p, d, dan f berturut-turut adalah 2, 6, 10, dan 14 elektron.
Bagaimana cara elektron dari suatu atom menempati orbital? Penjelasan mengenai cara pengisian elektron berdasarkan empat aturan konfigurasi elektron s p d f dapat disimak melalui ulasan di bawah.
Table of Contents
- 1) Prinsip Aufbau
- 2) Aturan Hund
- 3) Larangan Pauli
- 4) Aturan Penuh dan Setengah Penuh
- Contoh Soal dan Pembahasan
1) Prinsip Aufbau
Prinsip Aufbau mengatur pengisian elektron akan secara bertahap menempati suatu orbital dimulai dari sub kulit dengan tingkat energi paling rendah. Kondisi ini sesuai dengan kata Aufbau (dalam bahasa Jerman) yang bermakna meningkat. Dengan kata lain, pengisian elektron berawal dari subkulit dengan tingkat energi paling rendah meningkat ke sub kulit dengan energi yang lebih tinggi.
Pengisian elektron akan beralih ke subkulit berikutnya setelah orbital sub kulit berenergi rendah terisi penuh. Pengisian elektron terjadi begitu seterusnya sampai semua elektron dalam atom menempati orbitalnya. Berikut adalah gambar urutan tingkat energi untuk pengisian elektron berdasarkan Aturan Aufbau dalam aturan konfigurasi elektron s p d f.

Baca Juga: Cara Mengetahui Jumlah Proton, Nutron, dan Elektron dari Suatu Atom
2) Aturan Hund
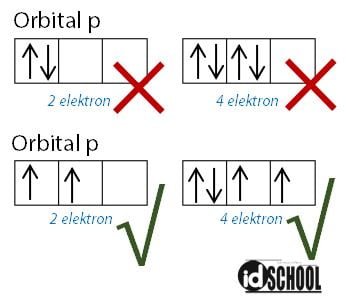
Aturan Hund digunakan pada saat elektron-elektron menempati orbital-orbital pada setiap sub kulit. Kaidah ini pertama kali dikemukakan oleh Friedrich Hund yang merupakan seorang ahli kimia Jerman. Pengisian elektron menurut kaidah Hund dalam aturan konfigurasi elektron s p d f tidak akan berpasangan sebelum orbital-orbital dalam satu subkulit sudah terisi penuh.
Elektron akan menempati orbital dengan arah yang sama terlebih dahulu. Setelah orbital dalam sub kulit terpenuhi oleh elektron dengan arah yang sama kemudian elektron akan mengisi orbital dengan arah berlawanan. Sehingga, sebuah orbital akan terisi penuh oleh dua elektron dengan arah yang berlawanan.
Arah elektron yang menempati orbital dijelaskan dalam bilangan kuantum spin. Arah putaran elektron yang searah jarum jam memiliki nilai s = +1, dengan simbol tanda panah ke atas. Sedangkan arah putaran elektron yang berlawanan arah jarum jam memiliki nilai s = -1 (simbol tanda panah ke bawah).
Perhatikan contoh pengisian elektron pada subkulit yang benar dan contoh yang salah berikut sesuai aturan konfigurasi elektron s p d f berikut.
Baca Juga: Sifat Atom Berdasarkan Urutannya dalam Tabel Periodik Unsur
3) Larangan Pauli
Larangan Pauli pertama kali disampaikan Wolfgang Pauli bahwa dalam suatu sistem (baik atom maupun molekul) tidak ada dua elektron yang mempunyai empat bilangan kuantum yang sama. Atau, dapat dikatakan bahwa setiap elektron dari suatu atom atau molekul selalu memiliki empat bilangan kuantum yang berbeda.
Bilangan kuantum adalah bilangan yang menyatakan kedudukan/posisi elektron dalam suatu nilai. Ada empat bilangan kuantum yang digunakan untuk menyatakan kedudukan elektron. Keempat bilangan kuantum tersebut meliputi bilangan kuantum utama (n), azimuth (l), magnetik (m), dan spin (s).
Elektron-elektron pada suatu atom akan selalu memiliki nilai bilangan kuantum yang berbeda. Kondisi ini terjadi karena setiap orbital hanya dapat ditempati oleh dua elektron.
Apabila ada 2 elektron yang menempati orbital yang sama, artinya mempunyai bilangan kuantum utama, azimuth, dan magnetik yang sama. Namun kedua elektron memiliki bilangan kuantum spin yang berbeda.
4) Aturan Penuh dan Setengah Penuh
Aturan konfigurasi elektron s p d f penuh-setengah penuh terjadi pada atom dengan golongan B yaitu pada pengisian elektron pada subkulit d. Elektron yang berisi penuh d10 dan setengah penuh d5 akan relatif lebih stabil. Sehingga, elektron cenderung akan mengisi orbital secara penuh atau setengah penuh.
Sebagai contoh konfigurasi atom 24Cr akan relatif lebih stabil dengan konfigurasi elektron [Ar] 4s1, 3d5 dari pada konfigurasi elektron [Ar] 4s2 3d4.

Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal dilengkapi pembahasan bagaimana penerapan aturan konfigurasi elektron s p d f. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Aturan Konfigurasi Elektron s p d f
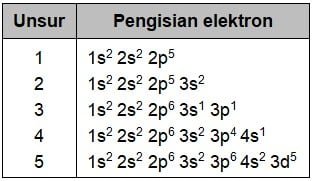
Perhatikan tabel pengisian elektron-elektron di atas! Pengisian elektron yang benar menurut aturan Aufbau dan Hund adalah ….
A. 1 dan 5
B. 1 dan 2
C. 2 dan 5
D. 3 dan 5
E. 4 dan 5
Pembahasan:
Aturan Aufbau dan Hund adalah dua dari 4 aturan konfigurasi elektron s p d f yang menjelaskan bagaimana cara elektron menempati kulit, subkulit, serta orbital.
- Asas Aufbau: pada kondisi normal atau tingkat dasar, elektron akan menempati orbitas yang memiliki energi terendah terlebih dahulu dan diteruskan ke orbital yang memilki energi lebih tinggi. Urutan pengisian elektron: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 … dan seterusnya.
- Aturan Hund: elekton yang mengisi subkulit dengan jumlah orbital lebih dari satu akan tersebar pada orbital yang mempunyai kesamaan energi dengan arah putaran (spin) yang sama.
Dari lima konfigurasi elektron yang diberikan ada dua cara pengisian elektron yang benar. Sedangkan cara pengisian elektron yang salah ada sebanyak tiga. Keterangan cara pengisian elektron yang benar dan salah terdapat pada keterangan berikut.
- 1s2 2s2 2p5 → benar
- 1s2 2s2 2p5 3s2 → salah, pada 2p5 diisi penuh terlebih dahulu menjadi 2p6
- 1s2 2s2 2p6 3s1 3p1 → salah, pada 3s1 diisi penuh terlebih dahulu menjadi 3s2
- 1s2 2s2 2p6 3s2 3p4 4s1 → salah, pada 3p4 diisi penuh terlebih dahulu menjadi 3p6
- 1s2 2s2 2p6 3s2 3p6 4s2 3d5 → benar
Jadi, pengisian elektron yang benar menurut aturan Aufbau dan Hund adalah 1 dan 5.
Jawaban: A
Contoh 2 – Soal Aturan Konfigurasi Elektron s p d f
Diagram orbital yang tepat untuk elektron valensi unsur Y dengan nomor atom 24 adalah ….
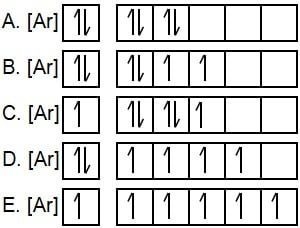
Pembahasan:
Konfigurasi elektron yang sesuai untuk 24Y adalah 1s2 2s2 2p6 3s2 3p6 4s2 3d4 atau dapat juga dituliskan menjadi 24Y = [Ar] 4s2 3d4. Berdasarkan aturan konfigurasi elektron s p d f penuh-setengah penuh, elektron akan menempati orbital setengah penuh pada 4s dan 3d. Sehingga konfigurasi elektron menjadi 24Y = [Ar] 4s1 3d5 yang sesuai dengan gambar orbital pada pilihan E.
Jadi, diagram orbital yang tepat untuk elektron valensi unsur Y dengan nomor atom 24 adalah [Ar] 4s1 3d5.
Jawaban: E
Contoh 3 – Soal Aturan Konfigurasi Elektron s p d f
Jumlah elektron tidak berpasangan pada ion Fe3+ adalah …. (nomor atom Fe = 26)
A. 2
B. 3
C. 4
D. 5
E. 6
Pembahasan:
Prinsip Aufbau menerangkan bahwa pengisian elektron dimulai dari tingkat energi terendah menuju energi tingkat energi yang lebih tinggi. Sehingga pengisian elektron akan mengikuti urutan: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 … dan seterusnya.
Konfigurasi elektron Fe:
26Fe = 1s2 2s2 2p6 3s2 3p6 4s2 3d6
Ion Fe3+ artinya atom Fe yang melepas 3 elektron, di mana elektron yang dilepas adalah elektron yang berada pada kulit terluar. Pada atom Fe elektron yang dilepas adalah elektron pada subkulit 4s2 sebanyak 2 elektron dan 3d6 sebanyak 1 elektron.
Konfigurasi elektron Fe3+:
23Fe3+ = 1s2 2s2 2p6 3s2 3p6 3d5
Menurut aturan Hund, elektron harus menempati seluruh orbital terlebih dahulu dengan arah (spin) yang sama. Dari hasil konfigurasi elektron tersebut, semua orbital s dan p terisi penuh. Sementara orbital d berisi setengah penuh atau ada lima elektron yang tidak berpasangan.

Jadi, jumlah elektron tidak berpasangan pada ion Fe3+ adalah 5.
Jawaban: D
Demikianlah tadi ulasan 4 aturan konfigurasi elektron s p d f pada teori atom mekanika kuantum. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Konfigurasi Elektron pada Model Bohr dan Mekanika Kuantum
