Cara menentukan harga bilangan kuantum berguna untuk mengetahui letak atau kedudukan elektron dari suatu atom. Letak elektron pada model atom mekanika kuantum menempati orbital yang menyusun sub kulit atom. Di mana orbital adalah ruang (awan) tempat kebolehjadian terbesar ditemukannya elektron dari suatu atom. Ada empat bilangan kuantum yang menunjukan posisi atau letak kedudukan elektron dari suatu atom. Keempat bilangan kuantum tersebut meliputi bilangan kuantum utama (n), azimuth (ℓ), magnetik (m), dan spin (s).
Setiap elektron pada suatu atom menempati orbital yang hanya dapat memuat dua buah elektron dengan arah yang berlawanan. Sehingga setiap elektron pada suatu atom memiliki harga bilangan kuantum yang berbeda-beda. Bagaimana cara menentukan empat harga bilangan kuantum? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Bilangan Kuantum
- 4 Harga Bilangan Kuantum
- Simpulan Ringkasan Harga Bilangan Kunatum
- Contoh Soal Cara Menentukan Harga Bilangan Kuantum dan Pembahasannya
Bilangan Kuantum
Bilangan kuantum adalah bilangan yang menunjukkan dimana letak kedudukan elektron pada suatu atom. Di mana bilangan kuantum diperoleh dari hasil konfigurasi elektron pada model mekanika kuantum. Nilai atau harga empat bilangan kuantum mewakili letak posisi atau kedudukan elektron dari suatu atom. Empat harga bilangan kuantum menunjukkan di mana letak kulit, sub kulit, orbital, dan arah gerak putar elektron.
Sebagai contoh, elektron dari atom Oksigen (nomor atom: 8) memiliki konfigurasi 8O = 1s2 2s2 2p4. Kumpulan deret bilangan kuantum pada konfigurasi elektron teori mekanika kuantum menunjukkan elektron pada sub kuit dengan energi rendah ke tinggi. Atau dapat diketakan bahwa energi terendah pada konfigurasi elektron untuk atom oksigen terdapat pada 1s, sementara energi paling tertinggi terdapat pada 2p.
Bilangan kuantum yang biasanya dianggap penting adalah bilangan kuantum pada orbital dengan energi paling tinggi (urutan terakhir). Misalnya pada konfigurasi elektron untuk atom oksigen 8O = 1s2 2s2 2p4 memiliki elektron terakhir yang ditunjukkan melalui bilangan kuantum 2p4.
Harga empat bilangan kuantum dari 2p4 masing-masing harga bilangan kuantum adalah n = 2, ℓ = 1, m = –1, dan s = –1/2. Bagaimana cara menentukan harga atau nilai n, ℓ, m, dan s akan menjadi bahasan utama di halaman ini.

Baca Juga: Perkembangan Teori Atom
4 Harga Bilangan Kuantum
Sebuah atom terdiri dari proton dan neutron pada inti atom yang dikelilingi oleh elektron pada kulit atom. Kulit atom memuat sub kulit atom yang tersusun atas orbital di mana menjadi tempat kebolehjadian tersbesar adanya elektron. Kata kebolehjadian tersebut dikarenakan adanya prinsip ketidakpastian W. Heisenberg yang menerangkan bahwa posisi elektron mengelilingi inti atom tidak dapat ditentukan secara pasti.
Bilangan kuantum menyatakan letak kedudukan elektron dari suatu atom melalui sebuah harga atau nilai. Diketahui bahwa ada empat bilangan kuantum yang berguna untuk menunjukkan letak elektron. Empat bilangan kuantum beserta keterangan nilainya terdapat pada daftar berikut.
- Utama (n): keterangan nomor kulit
- Azimuth (ℓ): keterangan sub kulit
- Magnetik (m): letak orbital
- Spin (s): arah perputaran elektron terakir
Penjelasan masing-masing empat bilangan kuantum beserta bagaimana cara menentukan harganya dijelaskan melalui masing-masing ulasan berikut.
1) Bilangan Kuantum Utama (n)
Pada model atom Bohr, sebuah atom terdiri dari proton dan neutron dalam inti atom yang dikelilingi oleh elektron. Elektron dalam sebuah atom berada di kulit atom yang berlapis dan dinyatakan sebagai kulit K, L, M, N, dan seterusnya. Pada teori atom model mekanika kuantum, letak elektorn pada kulit atom dinyatakan dalam bilangan kuantum utama n = 1, 2, 3, dan seterusnya.
Bilangan kuantum utama (n) menyatakan tingkat energi utama atau kulit atom. Nilai atau harga bilangan kuantum utama merupakan bilangan bulat mulai dari 1 sampai tak terhingga.
Bilangan kuantum utama n = 1 menunjuk elektron terletak pada kulit K, n = 2 menunjuk elektron berada pada kulit L, dan seterusnya.
2) Bilangan Kuantum Azimuth (ℓ)
Bilangan kuantum Azimuth (ℓ) menyatakan bentuk orbital tempat elektron pada sub kulit dengan nilai ℓ = 0, 1, 2, 3, dan seterusnya. Nilai ℓ = 0 menandakan bahwa elektron terletak pada sub kulit s dengan bentuk orbital s digambarkan melalui 1 buah ruang kotak. Bilangan Azimuth ℓ = 1 menunjukkan bahwa elektron terletak pada sub kulit p dengan bentuk orbital p berupa 3 buah ruang kotak.
Banyak orbital-orbital pada sub kulit dinyatakan dalam persamaan 2ℓ + 1, sehingga banyak orbital akan selalu berupa bilangan ganjil. Misalnya pada sub kulit d, nilai ℓ = 2 maka banyak orbital d = 2ℓ + 1 = 2 × 2 + 1 = 5 orbital. Untuk sub kulit f, bilangan kuantum azimuth ℓ = 3 dan banyak orbital = 7 orbital.

Ruang dalam orbital-orbital merupakan tempat yang akan ditempati elektron. Setiap kotak orbital hanya akan memuat dua buah elektron dengan arah putaran yang berlawanan.
Baca Juga: Cara Menentukan Jumlah Proton, Neutron, dan Elektron pada Suatu Atom
3) Bilangan Kuantum Magnetik (m)
Bilangan kuantum magnetik (m) menyatakan letak elektron pada suatu orbital dengan nilai bilangan kuantum m = …, –1, 0, +1, …. Harga atau nilai bilangan kuantum magnetik menyatakan nilai-nilai pada setiap ruang orbital pada bilangan Azimuth.
Pada ℓ = 0 terdapat satu kotak orbital dengan nilai 0, untuk ℓ = 1 terdapat tiga kotak orbital dengan nilai –1 ≤ m ≤ +1. Untuk ℓ = 2 terdapat lima kotak orbital dengan nilai –2 ≤ m ≤ +2. Untuk ℓ = 1 terdapat tujuh kotak orbital dengan nilai –3 ≤ m ≤ +3.
Harga bilangan kuantum magnetik sama dengan nilai pada orbital terakhir yang ditempati elektron. Sebagai contoh elektron dalam bilangan kuantum 2p4 memiliki hargag bilangan kuantum magnetik m = –1. Harga bilangan magnetik tersebut diperoleh melalui cara seperti gambar di bawah.
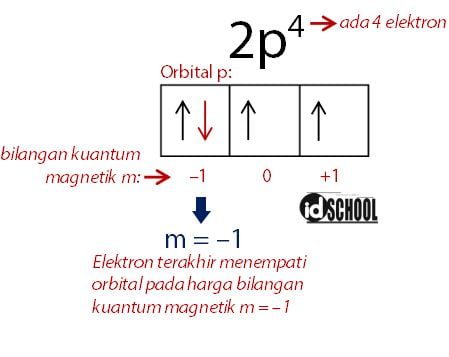
Baca Juga: Konfigurasi Elektron Model Bohr dan Mekanika Kuantum
4) Harga Bilangan Kuantum Spin (s)
Bilangan kuantum spin (s) menyatakan arah perputaran elektron yang berada dalam kotak orbital. Ada dua nilai atau harga bilangan kuantum spin yaitu s = –1/2 dan s = +1/2.
- s = –1/2: arah perputaran elektron berlawanan jarum jam
- s = +1/2: arah putaran elektron searah jarum jam
Dalam kotak orbital, elektron yang searah dengan jarum jarm digambarkan dengan anak panah keatas. Sedangkan elektron yang berputar berlawanan arah jarum jam digambarkan dengan anak panah ke bawah.
Harga bilangan kuantum spin s = +1/2 jika elektron terakhir yang menempati orbital adalah tanda anak panah ke atas dan s = –1/2 jika elektron terakhir yang menempati orbital adalah tanda anak panah ke bawah.

Simpulan Ringkasan Harga Bilangan Kunatum
Bahasan mengenai empat harga bilangan kuantum telah diuraikan pada masing-masing bahasan di atas. Secara ringkas, empat harga bilangan kuantum dan keterangannya sesuai dengan isi sheet berikut.

Baca Juga: 4 Aturan Konfigurasi Elektron s p d f (Teori Mekanika Kuantum)
Contoh Soal Cara Menentukan Harga Bilangan Kuantum dan Pembahasannya
Sobat idschool dapat menambah pemahaman bahsan di atas melalui beberapa contoh soal di bawah. Setiap contoh soal yang diberikan disertai dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat berlatih!
Contoh 1 – Soal Menentukann Harga Empat Bilangan Kuantum dari Suatu Atom

Pembahasan:
Konfigurasi elektron 16S = 1s2 2s2 2p6 3s2 3p4
Elektron terakhir beradalah pada bilangan kuantum 3p4
Harga bilangan kuantum utama (n) dan azimuth (ℓ) untuk elektron terakhir dari 16S:
- Kulit 3 → bilangan kuantum utama: n = 3
- Sub kulit p → bilangan kuantum Azimuth: ℓ = 1
Harga bilangan kuantum Azimuth ℓ = 1 = orbital p yaitu orbital dengan 3 kotak yang dapat diisi elektron. Perhatikan gambar berikut untuk menentukan harga bilangan kuantum magnetik (m) dan spin (s).

Harga bilangan kuantum magnetik (m) dan spin (s) untuk elektron terakhir dari 16S:
- Bilangan kuantum magnetik = nilai/harga kotak orbital yang ditempati elektron terakhir: m = –1
- Bilangan kuantum spin → elektron terakhir yang menempati orbital adalah anak panah ke bawah: s = –1/2
Jadi, harga keempat bilangan kuantum elektron terakhir dari 16S adalah n = 3, ℓ = 1, m = –1, s = –1/2.
Jawaban: B
Contoh 2 – Soal Menganalisa Harga Bilangan Kuantum yang Mungkin pada Suatu Atom
Bilangan-bilangan kuantum yang mungkin dimiliki oleh suatu elektron adalah ….
A. n = 2; ℓ = 2; m = 0; s = +1/2
B. n = 3; ℓ = 0; m = +1; s = +1/2
C. n = 4; ℓ = 2; m = –2; s = +1/2
D. n = 3; ℓ = 3; m = 0; s = –1/2
E. n = 2; ℓ = 2; m = 0; s = –1/2
Pembahasan:
Sobat idschool perlu menganalisis empat harga bilangan kuantum agar dapat mengetahui bilangan kuantum yang mungkin pada suatu elektron. Miasalnya, pada kulit utama n = 1 hanya terdapat orbital s (ℓ = 0) dan harga bilangan kuantum magnetik m = 0.
Pada kulit utama n = 2 terdapat orbital s (ℓ = 0) dan orbital p (ℓ = 1). Orbital p (ℓ = 1) memiliki tiga kotak dengan nilai bilangan kuantum magnetik m = –1, 0, 1. Dengan kata lain, tidak ada bilangan kuantum dengan ℓ = 1 dan bilangan m di luar nilai –1 ≤ m ≤ 1.
Sebagai contoh, analisis harga bilangan kuantum n = 2; ℓ = 2; m = 0; s = +1/2:
- bilangan kuantum n = 2 → memiliki orbital s (ℓ = 0) dan orbital p (ℓ = 1)
- tidak mungkin ada ℓ = 2 (orbital d)
Sehingga, empat harga bilangan kuantum untuk n = 1; ℓ = 1; m = +1; s = +1/2 tidak mungkin ada. (Pilihan A salah). Selanjutnya periksa harga bilangan kuantum n = 4; ℓ = 2; m = –2; s = +1/2:
- bilangan kuantum n = 4 → memiliki orbital s (ℓ = 0), orbital p (ℓ = 1), orbital d (ℓ = 2), dan orbital f (ℓ = 3)
- ℓ = 2 (orbital s) → memenuhi → nilai m yang mungkin m = –2, –1, 0, +1, +2
- bilangan kuantum magnetik: m = + 1 → memenuhi
- bilangan kuantum spin: s = + 1/2 → memenuhi
Jadi, keempat bilangan kuantum yang mungkin untuk suatu elektron adalah n = 4; ℓ = 2; m = –2; s = +1/2.
Jawaban: C
Contoh 3 – Soal Harga Bilangan Kuantum
Berikut ini adalah deretan bilangan kuantum yang dimiliki oleh suatu elektron.
1) n=3, l=0, m=0, s=–1/2
2) n=3, l=1, m=+1, s=+1/2
3) n=3, l = 1, m=+2, s=–1/2
4) n=3, l = 2, m=–1, s=+1/2
5) n=3, l = 2, m=+2, s=+1/2
Deretan bilangan kuantum yang tidak mungkin adalah adalah nomor ….
A. 1) dan 3)
B. 2) dan 4)
C. hanya 3)
D. hanya 4)
E. hanya 5)
Pembahasan:
Analisis harga bilangan kuantum untuk kelima nilai yang diberikan terdapat pada bahasan di bawah.
- n=3, l=0, m=0, s=–1/2 → 3s2
- n = 3, l = 1, m = +1, s = +1/2 → 3p3
- n = 3, l = 1, m= +2, s = –1/2 → orbital p tidak mungkin memiliki nilai bilangan magnetik m = + 2 karena nilai m untuk orbital p adalah m = –1, 0, + 1
- n = 3, l = 2, m = –1, s = +1/2 → 3d2
- n = 3, l = 2, m = +2, s = +1/2 → 3d5
Jadi, deretan bilangan kuantum yang tidak mungkin adalah adalah nomor 3.
Jawaban: C
Demikianlah tadi ulasan cara menentukan harga empat bilangan kuantum yang terdiri dari bilangan kuantum utama, azimuth, magnetik, dan spin. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Ikatan Kimia (Ion, Kovalen, dan Logam)
