Hukum tentang gas ideal meliputi empat hukum yang terdiri dari Hukum Boyle, Hukum Charles, Hukum Gay Lussac, Hukum Boyle-Gay Lussac. Dari setiap hukum tentang gas tersebut memuat persamaan yang berlaku sesuai bunyi hukum. Gas ideal adalah gas yang memenuhi beberapa anggapan-anggapan yang membahas sifat-sifat gas. Di mana ada enam sifat gas ideal yang menerangkan bagaimana jumlah, ukuran, dan gerak partikel-partikel gas.
Sifat gas pertama adalah gas terdiri atas partikel-partikel yang jumlahnya sangat banyak. Kedua, partikel-partikel gas bergerak dengan laju dan arah yang beraneka ragam serta memenuhi Hukum Gerak Newton. Ketiga, partikel gas tersebar merata pada seluruh bagian ruangan yang ditempati. Keempat, tidak ada gaya interaksi antarpartikel kecuali ketika partikel bertumbukan. Sifat gas ideal yang kelima adalah tumbukan yang terjadi antar partikel atau antara partikel dengan dinding wadah adalah lenting sempurna. Dan keenam, ukuran partikel sangat kecil dibandingkan jarak antara partikel sehingga volumenya dapat diabaikan terhadap volume ruang yang ditempati.

Gas merupakan zat yang volume dan bentuknya selalu berubah-ubah yang menempati suatu ruang dengan jarak antar partikel yang jauh. Kondisi tersebut membuat daya tarik antar partikel menjadi lemah.
Ada empat hukum tentang gas ideal dan menerangkan persamaan yang berlaku untuk gas ideal. Bagaiamana bunyi dari masing-masing hukum tentang gas? Apa saja persamaan yang berlaku sesuai hukum tentang gas ideal? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
Baca Juga: Hukum Newton I, II, III
Hukum Boyle
Volume gas dalam suatu ruang tertutup sangat bergantung pada tekanan (P) dan suhu (T). Ketika suhu dijaga dalam keadaan tetap atau konstan, besar tekanan yang diberikan akan memperkecil nilai volumenya. Hubungan antara tekanan (P) dan volume (V) tersebut dikenal dengan Hukum Boyle.
Bunyi Hukum Boyle:
“Apabila suhu gas yang berada dalam ruang tertutup dijaga konstan, maka tekanan gas berbanding terbalik dengan volumenya”.
Berdasarkan hukum tersebut dapat dikatakan bahwa besar tekanan berbanding terbalik dengan besar volume. Semakin besar tekanan yang diberikan pada gas akat membuat nilai volume gas semakin kecil. Sebaliknya, semakin kecil tekanan yang diberikan akan membuat nilai volume gas semakin besar.
Persamaan dari Hukum Boyle secara matematis dinyatakan melalui persamaan di bawah.

Hukum Charles
Volume gas dalam ruang tertutup dipengaruhi oleh besar suhu dan tekanan. Jika suhu gas dinaikkan maka gerak partikel-partikel gas akan semakin cepat sehingga volume gas bertambah. Sementara apabila tekanan tidak terlalu tinggi dan dijaga konstan (proses isobaris) maka volume gas akan bertambah terhadap kenaikan suhu. Hubungan antara volume dan suhu dikenal dengan Hukum Charles.
Bunyi hukum Charles:
“Apabila tekanan gas yang berada dalam ruang tertutup dijaga konstan maka volume gas berbanding lurus dengan suhu mutlaknya”.
Pernyataan dalam hukum tentang gas tersebut memiliki pengertian bahwa kenaikan suhu akan menyebabkan kenaikan volume. Begitu juga sebaliknya, penurunan suhu akan menyebabkan penurunan volume. Secara matematis, pernyataan yang terdapat pada Hukum Charles dinyatakan dalam persamaan berikut.

Baca Juga: Hukum Avogadro dan Penerapannya
Hukum Gay Lussac
Sebuah botol berisi gas yang berada dalam keadaan tertutup dapat meledak saat diberi tambahan suhu. Kondisi tersebut terjadi karena tekanan gas dalam botol meningkat karena adanya kenaikan suhu. Tekanan dan suhu juga memiliki hubungan yang ditetapkan dalam hukum Gay Lussac.
Kesimpulan dari peristiwa tersebut adalah kenaikan suhu akan membuat besar tekanan gas meningkat dan penurunan suhu akan membuat tekanan gas menurun. Pernyataan yang sesuai dengan kondisi tersebut terdapat dalam bunyi Hukum Gay Lussac.
Bunyi hukum Gay Lussac:
“Apabila volume gas yang berada pada ruang tertutup dijaga konstan, maka tekanan gas berbanding lurus dengan suhu mutlaknya”.
Secara matematis pernyataan yang sesuai dengan hukum tentang gas berdasarkan bunyi hukum Gay Lussac dinyatakan melalui persamaan berikut.

Baca Juga: Hukum Perbandingan Volume – Gay Lussac
Hukum Boyle–Gay Lussac
Tiga hukum yang telah dibahas di atas menyatakan bahwa ada hubungan antara tekanan (P), volume (V), dan suhu (T) gas. Hukum Boyle-Gay Lussac merangkum ketiga hukum tersebut dalam sebuah persamaan. Secara matematis, hubungan tekanan, volume, dan suhu gas dinyatakan melalui persamaan di bawah.

Contoh Soal dan Pembahasan
Beberaoa soal berikut dapat sobat idschool gunakan untuk mengukur pemahaman materi terkait bahasan di atas. Setiap contoh soal gas ideal di bawah dilengkapi dengan pembahasan bagaimana penggunaan hukum tentang gas. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih
Contoh 1 – Sifat Gas Ideal Berdasarkan Hukum Tentang Gas
Perhatikan pernyataan berikut!
(1) Partikel gas tidak tersebar merata dalam ruangan
(2) Partikel-partikel gas bergerak dengan bebas
(3) Tumbukan antar partikel lenting sebagian
(4) Ukuran partikel sangat dibandingkan ruang yang ditempati
(5) Gerakan partikel memenuhi Hukum Newton
Pernyataan yang benar tentang sifat gas ideal disebutkan oleh nomor ….
A. (1), (2), dan (3)
B. (1), (3), dan (5)
C. (2), (3), dan (4)
D. (2), (4), dan (5)
E. (3), (4), dan (5)
Pembahasan:
Pada gas ideal memenuhi sifat-sifat:
- Partikel gas tersebar merata dalam ruangan
- Partikel-partikel gas bergerak dengan bebas (2)
- Jenis tumbukan antar partikel atau tumbukan partikel dengan dinding wadah adalah lenting sempurna
- Ukuran partikel sangat dibandingkan ruang yang ditempati (4)
- Gerakan partikel memenuhi Hukum Newton (5)
Jadi, pernyataan yang benar tentang sifat gas ideal disebutkan oleh nomor (2), (4), dan (5).
Jawaban: D
Baca Juga: Persamaan Umum Gas Ideal (PV = nRT)
Contoh 2 – Penggunaan Persamaan Sesuai Hukum Tentang Gas
Suatu gas yang suhunya 127oC dipanaskan menjadi 227oC pada tekanan tetap. Volume gas sebelum dipanaskan adalah V. Volume gas setelah dipanaskan adalah .…
A. 1/2 V
B. 1/3 V
C. 3/4 V
D. 4/5 V
E. 5/4 V
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Suhu pertama: T1 = 127o + 273o = 400oK
- Suhu kedua: T2 = 227o + 273o = 500oK
- Tekanan tetap
- Volume gas sebelum dipanaskan: V1 = V
Menghitung volume gas setelah dipanaskan (V2):
V1/T1 = V2/T2
V/400 = V2/500
400·V2 = 500·V
V2 = 500/400·V = 5/4·V
Jadi, volume gas setelah dipanaskan adalah 5/4 V.
Jawaban: E
Contoh 3 – Penggunaan Persamaan Sesuai Hukum Tentang Gas
Enam mol gas oksigen di dalam suatu tabung tertutup pada suhu kamar bertekanan 4 atm. Jika 1,5 mol gas tersebut telah digunakan maka tekanan gas di dalam tabung tersebut menjadi ….
A. 0,25 atm
B. 0,5 atm
C. 1,0 atm
D. 2,0 atm
E. 3,0 atm
Pembahasan:
Berdasarkan keterangan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Jumlah mol pada kondisi pertama: n1 = 6 mol
- Tekanan pada kondisi pertama: P1 = 4 atm
- Jumlah mol pada kondisi kedua: n2 =6 –1,5 = 4,5 mol
Menghitung tekanan gas oksigen di dalam tabung pada kondisi kedua:
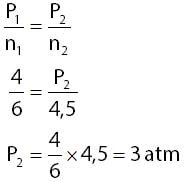
Jadi, tekanan gas di dalam tabung tersebut menjadi 3,0 atm.
Jawaban: E
Contoh 4 – Penggunaan Persamaan Sesuai Hukum Tentang Gas
Volume suatu gas ideal sebanyak 4 liter memiliki tekanan 1,5 atmosfer pada suhu27oC. Besar tekanan sebanyak 3,2 liter gas tersebut pada suhu 47oC adalah ….
A. 0,2 atm
B. 1 atm
C. 1,5 atm
D. 2 atm
E. 3 atm
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Volume gas pada kondisi pertama: V1 = 4 liter
- Tekanan gas pada kondisi pertama: P1 = 1,5 atm
- Suhu gas pada kondisi pertama: T1 = 27o + 273o = 300oK
- Volume gas pada kondisi kedua: V2 = 3,2 liter
- Suhu gas pada kondisi kedua: T2 : 47o + 273o = 330oK
Menghitung tekanan gas pada kondisi kedua (P2):
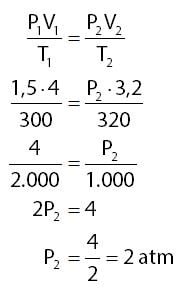
Jadi, besar tekanan sebanyak 3,2 liter gas tersebut pada suhu 47oC adalah 2 atm.
Jawaban: D
Demikianlah tadi ulasan materi empat hukum tentang gas dan persamaannya yang meliputi hukum Boyle, Charles, Gay Lussac, dan Boyle–Gay Lussac. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Hukum Kekekalan Massa – Lavoisier
