Rumus molekul senyawa merupakan rumus kimia yaitu rumus yang menyatakan banyaknya perbandingan unsur-unsur penyusun suatu senyawa. Selain rumus molekul, rumus kimia juga meliputi rumus empiris yang juga menyatakan perbandingan atom-atom yang menyusun suatu senyawa kimia. Perbedaan antara rumus empiris dan rumus molekul sennyawa terletak pada perbandingan pada rumus empiris yang lebih sederhana dari rumus molekul senyawa.
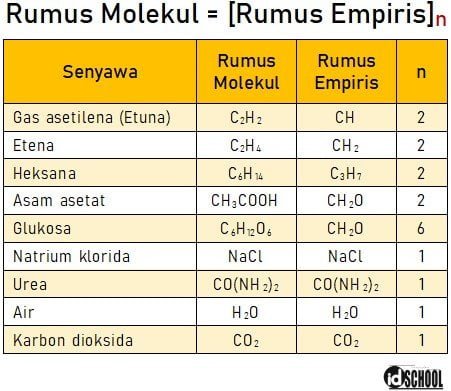
Hubungan antara rumus empiris dan rumus molekul senyawa dinyatakan dalam persamaan rumus molekul = [rumus empiris]n. Di mana, n merupakan angka indeks yaitu angka yang menyatakan kelipatan jumlah atom/unsur dalam suatu senyawa. Misalnya: senyawa glukosa memiliki rumus empiris CH2O dan rumus molekul C6H12O6. Perhatikan bahwa rumus molekul senyawa glukosa sama dengan enam rumus empirisnya. Atau dalam persamaan dituliskan [CH2O]6 = C6H12O6. Di sini nilai indeks untuk rumus empiris dan rumus molekul senyawa glukosa adalah n = 6.
Baca Juga: Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
tertentu. Bagaimana cara menentukan rumus molekul senyawa? Apa itu rumus empiris dan apa itu rumus molekul? Sobat idschool dapat mencari tahu lebih banyak bahasan mengenai rumus empiris dan rumus molekul senyawa melalui ulasan di bawah.
Table of Contents
- Rumus Empiris dan Rumus Molekul
- Langkah – Langkah Menentukan Rumus Empiris dan Rumus Molekul
- Contoh Cara Menentukan Rumus Molekul dan Pembahasan
Rumus Empiris dan Rumus Molekul
Rumus kimia terbagi menjadi dua yaitu rumus molekul dan rumus empiris. Rumus empiris menyatakan rumus kimia yang menggambarkan perbandingan mol terkecil dari atom-atom penyusun senyawa. Sedangkan rumus molekul adalah rumus sebenarnya dari suatu senyawa di mana dapat diketahui jika massa molekul relatif diketahui.
Semua senyawa mempunyai rumus empiris, pada beberapa banyak senyawa memiliki rumus empiris dan rumus molekul yang sama. Senyawa molekul dapat mempunyai rumus empiris dan rumus molekul, namun senyawa ion hanya mempunyai rumus empiris.
Semua senyawa yang mempunyai rumus molekul pasti memiliki rumus empiris. Namun, senyawa yang memiliki rumus empiris belum tentu mempunyai rumus molekul.

Rumus Empiris menyatakan rasio perbandingan terkecil dari atom – atom pembentuk senyawa, bukan menyatakan sebuah senyawa atau zat.
- Natrium klorida merupakan senyawa ion yang terdiri atas ion Na+ dan ion Cl– dengan perbandingan 1 : 1. Rumus kimia natrium klorida NaCl.
- Kalsium klorida merupakan senyawa ion yang terdiri atas ion Ca2+ dan ion Cl– dengan perbandingan 2 : 1. Rumus kimia kalsium klorida CaCl2.
Rumus Molekul adalah rumus yang menyatakan jumlah atom – atom dari unsur – unsur yang menyusun satu molekul senyawa. Ringkasnya, rumus molekul menyatakan susunan sebenarnya dari molekul zat.
- Rumus molekul air yaitu H2O yang berarti dalam satu molekul air terdapat dua atom hidrogen dan satu atom oksigen.
- Rumus molekul glukosa C6H12O6 yang berarti dalam satu molekul glukosa terdapat 6 atom karbon, 12 atom hidrogen, dan 6 atom oksigen.
Hubungan antara rumus empiris dan rumus molekul adalah rumus molekul merupakan kelipatan dari rumus empiris. Beberapa contoh rumus empiris dan molekul untuk beberapa senyawa sesuai dengan tabel berikut.
Baca Juga: Hukum Perbandingan Volume – Gay Lussac
Langkah – Langkah Menentukan Rumus Empiris dan Rumus Molekul
Langkah-langkah menentukan rumus empiris dan molekul berikut dapat sobat idschool gunakan sebagai cara menentukan rumus molekul senyawa. Terdapat lima langkah yang perlu sobat idschool lakukan untuk mendapatkan rumus molekul senyawa.
Langkah – langkah menentukan rumus empiris dan rumus molekul suatu senyawa meliputi beberapa langkah berikut.
1) Menghitung perbandingan massa unsur
2) Menghitung perbandingan mol
3) Menghitung perbandingan jumlah atom
4) Menentukan rumus empiris
5) Menentukan rumus molekul
Untuk lebih mendalami penggunaan cara menentukan rumus molekul senyawa, perhatikan contoh soal cara menentukan rumus molekul senyawa berikut yang telah dilengkapi dengan pembahasannya.
Baca Juga: Perhitungan Kimia – Konsep Mol
Contoh Cara Menentukan Rumus Molekul dan Pembahasan
Soal Menentukan Rumus Empiris dan Rumus Molekul:
Diketahui suatu senyawa mengandung C, H, dan O memiliki massa 4,5 gram dan Mr = 30. Jika gas oksigen yang digunakan murni ternyata menghasilkan 6,6 gram CO2 dan 2,7 gram H2O maka rumus empiris dan rumus molekul senyawa tersebut berturut – turut adalah ….
A. CH2O dan CH2O
B. CH2O dan C2H4O2
C. CH2O dan C3H6O4
D. CH2O dan C4H8O4
E. CH2O dan C5H10O5
Pembahasan:
Penyelesaian soal untuk menentukan rumus empiris dan rumus molekul senyawa meliputi langkah menentukan perbandingan massa unsur, perbandingan mol, perbandingan jumlah atom, menentukan rumus empiris, dan menentukan rumus molekul senyawa.
Langkah 1: menentukan massa unsur (C, H, dan O)
Massa C dalam CO2:
= n · C × Ar C/Mr CO2 × massa CO2
= 1 × 12/44 × 6,6
= 1,8 gr
Massa H dalam H2O:
= n · H × Ar H/Mr H2O × massa H2O
= 2 × 1/18 × 2,7
= 0,3 gr
Menghitung massa O:
= massa sampel – massa C – massa H
= 4,5 ‒ 1,8 ‒ 0,3
= 2,4 gr
Langkah 2: menentukan perbandingan mol
Banyak unsur C (dalam mol):
= massa C/Ar C
= 1,8/12
= 0,15
Banyak unsur H (dalam mol):
= massa H/Ar H
= 0,3/1
= 0,3
Banyak unsur O (dalam mol):
= massa O/Ar O
= 2,4/16
= 0,15
Langkah 3: menghitung perbandingan jumlah atom
Perbandingan jumlah atom C : H : O melalui perbandingan mol C : H : O = 0,15 : 0,3 : 0,15 = 1 : 2 : 1
Langkah 4: menentukan rumus empiris
Diperoleh perbandingan jumlah atom C, H, dan O berturut – turut adalah 1, 2, dan 1. Sehingga, rumus empiris senyawa karbon tersebut adalah CH2O.
Langkah 5: menentukan rumus molekul
Mr Senyawa = [ CH2O ]n
30 = (Ar C + 2 × Ar H + Ar O) × n
30 = (12 + 2 × 1 + 16) × n
30 = 30n
n = 30/30 = 1
Rumus molekul senyawa tersebut adalah (CH2O)n = (CH2O)1 = CH2O.
Jadi, senyawa tersebut memiliki rumus empiris dan rumus molekul berturut – turut adalah CH2O dan CH2O.
Jawaban: A
Demikianlah tadi ulasan materi mengenai cara menentukan rumus molekul senyawa. Bahasan meliputi rumus kimia (rumus empiris dan rumus molekul), langkah – langkah menentukan rumus molekul, dan contoh soal cara menentukan rumus molekul yang telah dilengkapi dengan pembahasannya. Terimakasih sudah mengunjungi idshool(dot)net, semoga bermanfaat.
Baca Juga: 5 Hukum Kimia Dasar