Sel volta dan sel elektrolisis merupakan sel elektrokimia yaitu suatu sistem berupa rangkaian yang terdiri atas larutan elektrolit dan elektroda (anoda/katoda). Perbedaan sel volta dan elektrolisis terletak pada kemampuan mengubah jenis energi kimia ke energi listrik atau sebaliknya. Di mana sel volta adalah sel elektrokimia yang dapat mengubah energi kimia menjadi energi listrik. Sedangkan sel elektrolisis adalah sel elektrokimia yang dapat mengubah energi listrik menjadi energi kimia.
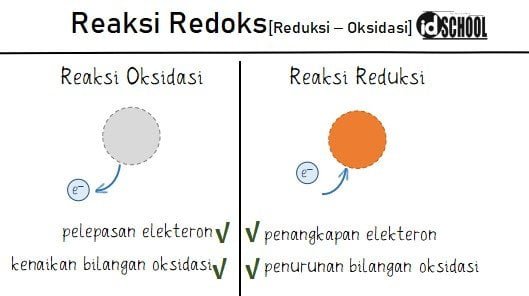
Pengertian dari elektrokimia sendiri adalah adalah cabang ilmu kimia yang mempelajari hubungan kelistrikan dengan reaksi kimia. Ada dua reaksi kimia yang terlibat pada sel elektrokimia yaitu reaksi reduksi dan oksidasi. Sehingga, sebelumnya perlu mengetahui apa itu reaksi reduksi dan apa itu reaksi oksidasi. Di mana, reaksi oksidasi adalah reaksi kimia yang ditandai pelepasan elektron atau kenaikan bilangan oksidasi. Sedangkan reaksi eduksi adalah reaksi kimia yang ditandai penangkapan elektron atau penurunan bilangan oksidasi.
Baca Juga: Reaksi Reduksi dan Oksidasi (Reaksi Redoks)
Pada sel elektrokimia terdapat reaksi elektrokimia yang menyebabkan perpindahan elektron. Perpindahan elektron dapat menghasilkan arus listrik, perpindahan elektron dapat juga dikarenakan arus listrik. Cara perpindahan elektron yang berbeda membuat sel elektrokimia dibedakan menjadi dua jenis yaitu sel volta dan elektolisis.
Selain kemampuannya dalam mengubah energi dan cara perpindahan elektron, perbedaan sel volta dan elektrolisis juga terdapat pada beberapa bagian. Apa saja perbedaan sel volta dan sel elektrolisis? Bagaimana cara kerja sel volta? Bagaimana cara kerja sel elektrolisis? Sobat idschool dapat mencari tahu jawaban perbedaan sel volta dan elektrolisis melalui ulasan di bawah.
Table of Contents
Sel Volta
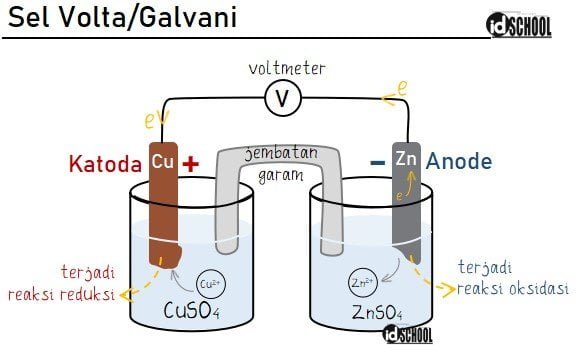
Tokoh dibalik teori terbentuknya arus listrik dari reaksi kimia adalah Luigi Galvani dan Alessandro Volta. Sehingga sel elektrokimia yang dapat mengubah energi kimia ke energi listrik disebut Sel Galvani atau Sel Volta. Rangkaian diagram sel volta terdiri dari elektroda (anoda dan katoda), larutan elektrolit, rangkaian listrik bagian luar, serta jembatan garam. Contoh dari rangkaian sel volta terdapat pada baterai dan aki mobil/motor.
Cara kerja sel volta dapat diamati melalui logam Zn (seng) dalam larutan ZnSO4 [zink sulfat] dan logam Cu (tembaga) dalam larutan CuSO4 [tembaga (II) sulfat]. Antara logam Zn dan Cu dihubungkan oleh rangkaian luar berupa kabel/konduktor yang dapat menghantarkan listrik. Antara larutan ZnSO4 dan CuSO4 dihubungkan oleh jembatan garam (misalnya NaCl) sebagai penyeimbang larutan.
Diketahui bahwa Zn adalah logam yang lebih reaktif dibanding Cu. Sehingga logam Zn akan menjadi reduktor (lebih mudah teroksidasi) dan logam Cu adalah akan menjadi oksidator (lebih mudah tereduksi).
Logam Zn akan melepaskan elektron menjadi ion Zn2+ yang akan larut dalam seng sulfat. Elektron yang dilepaskan Zn mengalir melalui konduktor dan sampai pada logam Cu. Logam Cu yang kelebihan muatan akan menangkap ion Cu2+ dari larutan tembaga (II) sulfat menjadi Cu. Peran dari jembatan garam di sini adalah menyeimbangkan muatan pada kedua larutan tersebut.
Dari reaksi ini, logam Zn akan semakin tipis/habis dan logam Cu akan semakin menebal. Reaksi akan terus berlangsung sampai logam Zn atau ion Cu2+ habis.
Elektron dihasilkan pada logam Zn yaitu elektroda mengalami oksidasi (anoda), sehingga kutub negatif (‒) pada sel volta terdapat pada anoda. Logam lainnya yaitu Cu sebagai elektroda yang mengalami reduksi atau katoda pada sel volta merupakan kutub positif (+).
Dapat disimpulkan bahwa arus listrik (transfer elektron) pada sel volta terjadi dari anoda (kutub negatif) ke katode (kutub positif).
Baca Juga: Diagram Sel Volta + Contoh Soal & Pembahasan
Sel Elektrolisis
Sel elektrolisis adalah sel elektrokimia yang mengubah energi listrik menjadi energi kimia atau reaksi redoks spontan. Contoh sel elektrolisis dalam kehidupan sehari-hari dapat dijumpai pada pelapisan/penyepuhan logam, produksi sodium/natrium, produksi alumunium, dan pemurnian logam.
Rangkaian elektrolisis terdiri dari sumber listrik (sebagai penyuplai arus searah atau DC, misalnya: baterai), lelehan/larutan elektrolit, dan elektroda. Pada sel elektrolisis, sumber listrik luar (power supply) menyuplai elektron ke katode sehingga katode bermuatan negatif. Dengan demikian elektroda lainnya yaitu anoda akan bermuatan positif.
Ketika sumber arus disambungkan pada sel elektrolisis maka elektron dari sumber arus akan mengalir ke salah satu elektroda sehingga membuat elektroda bermuatan negatif (katoda). Muatan negatif akan menarik ion-ion positif pada larutan/lelehan elektrolit menuju elektroda tersebut. Di sisi lain, elektroda lainnya kelebihan muatan positif (anoda) sehingga menarik ion-ion negatif dari larutan.
iketahui bahwa katoda pada sel elektrolisis menerima/menangkap elektron sehingga di sama terjadi reaksi reduksi. Sedangkan anoda melepaskan elektron sehingga pada elektroda tersebut terjadi reaksi oksidasi.
Hasil reaksi yang terjadi di katoda/anoda pada sel elektrolisis bergantung dari dua faktor. Kedua faktor tersebut adalah jenis elektolit dan elektroda yang digunakan. Di mana faktor jenis elektolit merupakan larutan atau lelehan, serta elektroda yang digunakan berupa zat iner atau non inert.
Baca Juga: Reaksi yang Terjadi di Katoda/Anoda pada Sel Elektrolisis
Tabel Perbedaan Sel Volta dan Elektrolisis
Sebelum ke bahasan perbedaan sel volta dan elektrolisis, ingat kembali bagaimana karakteristik dari sel volta dan sel elektrolisis.
Karakteristik sel volta:
- Mengubah energi kimia menjadi energi listrik
- Katoda: elektroda yang mengalami reaksi reduksi
Anoda: elektroda yang mengalami reaksi oksidasi - Kutub positif (+): Katoda
Kutub negatif (‒): Anoda - Arah arus listrik (aliran elektron): anoda ke katoda
Karakteristik sel elektrolisis:
- Mengubah energi listrik menjadi energi kimia
- Katoda: elektroda yang mengalami reaksi reduksi
Anoda: elektroda yang mengalami reaksi oksidasi - Kutub positif (+): Anoda
Kutub negatif (‒): Katoda - Arah arus listrik (aliran elektron): anoda ke katoda
Dari beberapa karakteristik pada sel volta dan eletrolisis dapat diperleoh beberapa persamaan dari kedua sel. Di mana, persamaan atau yang bukan menjadi perbedaan sel volta dan elektrolisis meliputi jenis reaksi pada katoda/anoda dan arah arus listrik.

Dari karaketristik dua jenis sel elektrokimia tersebut dapat juga diperoleh perbdaan sel volta dan elektrolisis . Berikut ini adalah tabel perbedaan sel volta dan elektrolisis seperti berikut.

Demikianlah tadi ulasan perbedaan sel volta dan elektosis yang keduanya termasuk dalam sel elektrokimia. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Larutan Elektrolit Kuat dan Elektrolit Lemah