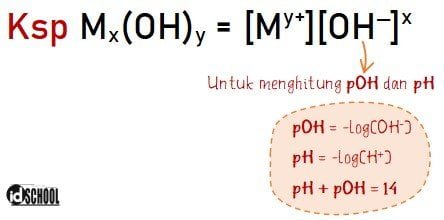
Hubungan Ksp dan pH memungkin untuk mengetahui nilai pH suatu larutan berdasarkan informasi nilai Ksp larutan. Kondisi ini juga berlaku untuk mengetahui besar kelarutan jika diketahui harga pH dari larutan tersebut.
Ksp atau hasil kali kelarutan adalah banyaknya mol zat terlarut (s) pada saat konsentrasi tepat jenuh. Nilai tetapan pada Ksp larutan diperoleh dari hasil kali konsentrasi ion-ion pada larutan jenuh yang telah dipangkatkan dengan koefisien dari persamaan ionisasi larutan.
Sedangkan pH merupakan kepanjangan dari Power of Hydrogen yaitu ukuran konsentrasi ion hidrogen dalam larutan. Pengertian pH dapat juga diartikan sebagai tingkat keasaman larutan.
Baca Juga: Rumus pH Larutan Asam dan Basa
Tingkat keasaman larutan (pH) dapat mempengaruhi kelarutan dari berbagai jenis zat. Bagaimana hubungan Ksp dan pH? Bagaimana pengaruh perubahan Harga pH larutan terhadap Ksp kelarutan? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Hubungan Ksp dan pH Larutan
- Pengaruh Perubahan Besar pH Terhadap Ksp Larutan
- Contoh Soal dan Pembahasan
Hubungan Ksp dan pH Larutan
Harga Ksp suatu zat/senyawa diperoleh dari kelarutan zat tersebut, di mana persamaan Ksp larutan sama dengan hasil kali ion-ion setelah dipangkatkan dengan koefisiennya. Dengan demikian dapat dikatakan juga bahwa kelarutan suatu zat dapat ditentukan dari harga Ksp zat tersebut.
Jika kelarutan suatu zat telah diketahui maka susunan konsentrasi ion-ion dalam larutran jenuhnya dapat ditentukan. Sehingga, dengan mengetahui harga Ksp suatu zat maka konsentrasi ion-ion zat tersebut dalam larutan jenuhnya dapat ditentukan. Dari sinilah hubungan Ksp dan pH dapat ditentukan.
Hubungan Ksp dan pH ditunjukkan seperti berikut.
Baca Juga: Rumus Kelarutan (s) dan Hasil Kali Kelarutan (Ksp)
Pengaruh Perubahan Besar pH Terhadap Ksp Larutan
Suatu basa pada umumnya akan lebih mudah larut dalam larutan yang bersifat asam dan akan lebih sukar larut dalam larutan basa. Sedangkan garam-garam yang berasal dari asam lemah akan mudah larut dalam larutan yang bersifat asam kuat. Ringkasnya, kelarutan dari suatu senyawa dipengaruhi oleh beberapa faktor yang salah satunya adalah pH larutan.
Tingkat keasaman larutan (pH) menunjukkan besar konsentrasi ion hidrogen yang terdapat pada suatu larutan. Semakin tinggi harga harga pH larutan maka larutan tersebut semakin banyak memiliki ion hidroksia OH‒. Di mana besarnya konsentrasi OH‒ menunjukkan sifat basa dari larutan.
Ingat kembali bahwa basa akan sukar larut dalam larutan basa. Sehingga, semakin besar pH larutan maka kelarutan semakin berkurang sehingga menjadi sukar larut atau lebih mudah mengendap. Atau, senyawa yang semakin sukar larut memiliki nilai hasil kelarutan yang semakin lebih kecil.
Baca Juga: Cara Menyimpulkan Hasil Indikator Larutan Asam/Basa
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan hubungan Ksp dan pH di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan bagaimana hubungan Ksp dan pH. Sobat idschool dapat menggunakan pembahasan hubungan Ksp dan pH tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Hubungan Ksp dan pH
Ksp larutan jenuh senyawa hidroksida dari suatu larutan logam M(OH)3 adalah 1/3 × 10‒20. Harga pH dari senyawa tersebut adalah ….
A. 5 ‒ log 3
B. 5
C. 5 + log 3
D. 9
E. 9 + log 3
Pembahasan:
Reaksi yang terjadi pada M(OH)3 dalam air: M(OH)3 (s) → M3+ (aq) + 3OH‒ (aq), persamaan Ksp untuk senyawa M(OH)3 dapat ditentukan seperti berikut.
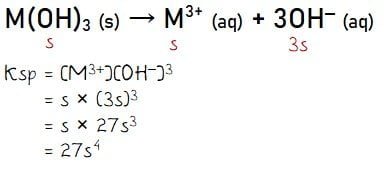
Diketahui Ksp M(OH)3 = 1/3 × 10‒20, sehingga dapat diperoleh nilai s seperti hasil dari penyelesaian berikut.
Ksp = 1/3 × 10‒20
27s4 = 1/3 × 10‒20
s4 = 1/3 × 10‒20 × 1/27
s4 = 1/81 × 10‒20
s = 1/3 × 10‒5
Menghitung konsentrasi OH‒:
[OH‒] = 3s
[OH‒] = 3 × 1/3 × 10‒5
[OH‒] = 10‒5
Harga pOH larutan logam M(OH)3:
pOH = ‒log [OH‒]
pOH = ‒log [10‒5]
pOH = log 105 = 5
Jadi, harga pH dari senyawa tersebut sama dengan pH = 14 ‒ pOH = 14 ‒ 5 = 9.
Jawaban: C
Contoh 2 – Hubungan Ksp dan pH
Diketahui pH larutan Pb(OH)2 sama dengan 12. Jika Ksp Pb(OH)2 = 1,2×10‒15 maka kelarutan Pb(OH)2 adalah ….
A. 6,0×10‒11 mol/L
B. 1,2×10‒11 mol/L
C. 6,0×10‒13 mol/L
D. 1,2×10‒13 mol/L
E. 1,0×10‒13 mol/L
Pembahasan:
Keterangan pada soal memberikan informasi bahwa larutan Pb(OH)2 memiliki pH = 12, sehingga pOH = 14 ‒ 12 = 2. Sehingga konsentrasi OH‒ dapat ditentukan seperti pada penyelesaian cara berikut.
Menentukan konsentrasi OH:
pOH = ‒log [OH‒]
2 = ‒log [OH‒]
‒log 10‒2 = ‒log [OH‒]
10‒2 = [OH‒]
Diperoleh konsentrasi OH‒: [OH‒] = 10‒2
Menghitung kelarutan Pb(OH)2:
Ksp Pb(OH)2 = [Pb2+][OH‒]2
1,2×10‒15 = s × (10‒2)2
s = 1,2×10‒15 : 10‒4
s = 1,2×10‒15‒(‒4)
= 1,2×10‒15+4
= 1,2×10‒11
Jadi, kelarutan Pb(OH)2 adalah s = 1,2×10‒11 mol/L.
Jawaban: B
Contoh 3 – Hubungan Ksp dan pH

Pembahasan:
Langkah pertama adalah menentukan berapa konsentrasi OH‒ pada larutan Al(OH)3 melalui nilai kelarutan s. Cara menentukan kelarutan untuk senyawa Al(OH)3 dapat diperoleh seperti pada penyelesaian cara berikut.
Ksp Al(OH)3 = 27×10‒32
[Al3+][OH‒]3 = 27×10‒32
[s][3s]3 = 27×10‒32
s × 27s3 = 27×10‒32
27s4 = 27×10‒32
s4 = 27/27 × 10‒32
s4 = 1 × 10‒32
s = 1 × 10‒32/4 = 1 × 10‒8 M
Konsentrasi OH‒:
[OH‒] = 3s
[OH‒] = 3 × 1 × 10‒8
[OH‒] = 3 × 10‒8 M
Menentukan pOH larutan:
pOH = ‒log [OH‒]
pOH = ‒log [3 × 10‒8]
pOH = ‒log 3 ‒ log 10‒8
pOH = ‒log 3 ‒ (‒log 108)
pOH = ‒log 3 + log 108
pOH = 8 ‒ log 3
Menentukan pH larutan:
pH = 14 ‒ pOH
pH = 14 ‒ (8 ‒ log 3)
pH = 14 ‒ 8 + log 3
pH = 6 + log 3
Jadi, pH larutan jenuh Al(OH)3 sama dengan 6 + log 3.
Jawaban: E
Contoh 4 – Hubungan Ksp dan pH
Kalsium dapat mengendap sebagai hidroksida dalam larutan yang mengandung 0,01 M Ca2+. Ion Ca2+ akan mulai mengendap pada pH = …. (Ksp Ca(OH)2 = 5,0 × 10‒6)
A. 12 + log 2,2
B. 12 ‒ log 2,2
C. 2,2 + log 12
D. 12 ‒ log 2,2
E. 2 ‒ log 2,2
Pembahasan:
Dari soal dapat diperoleh informasi besar molaritas ion Ca2+ = 0,01 M = 10‒2 M. Logam kalsium akan mulai mengendap ketika Qc = Ksp sehingga dapat diperoleh konsentrasi OH‒ seperti berikut.

Mengitung pOH larutan saat logam kalsium akan mulai mengendap:
pOH = ‒log [OH‒]
pOH = ‒log [2,2 × 10‒2]
pOH = ‒log 2,2 ‒ log 10‒2
pOH = ‒log 2,2 + 2 = 2 ‒ log 2,2
Menghitung pH larutan:
pH = 14 ‒ pOH
pH = 14 ‒ (2 ‒ log 2,2)
pH = 14 ‒ 2 + log 2,2
pH = 12 + log 2,2
Jadi, ion Ca2+ akan mulai mengendap pada pH = 12 + log 2,2.
Jawaban: A
Demikianlah tadi ulasan hubungan Ksp dan pH yang dapat digunakan untuk melihat apa kesamaan dari keduanya. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Diagram/Notasi Deret Volta dan Reaksi yang Terjadi pada Elektroda

Selamat siang Admin http://www.idschool.net,
Perkenalkan saya Harys Imanulloh dari Niagahoster, penyedia web hosting di Indonesia.
Kami menemukan artikel menarik yang Anda buat di http://www.idschool.net
Sehubungan dengan hal ini, saya ingin mengajak Anda untuk bekerja sama dengan Niagahoster dalam bentuk review layanan atau penulisan artikel (tema bebas) dengan link keluar ke Niagahoster (yang sesuai dengan niche blog Anda).
Apakah Anda tertarik dengan kerjasama seperti ini?
Bila tertarik dengan tawaran kami, silakan balas email ini dengan nomor telepon yang dapat dihubungi.
Di samping itu, silakan hubungi saya kapan saja melalui nomor +62 895-3790-34754 (phone/WA).
Saya tunggu kabar baiknya!
Halo, untuk kerjasama bisa hubungi email: idschool.net@gmail.com, terima kasih!
terima kasih atas info nya,