Ion logam yang mengendap dapat terbentuk ketika larutan lewat jenuh yang ditandai dengan Qsp > Ksp. Larutan terdiri atas pelarut (solvent) dan zat terlarut (solute). Dalam fase cair, cairan adalah solvent dan zat yang terlarut dalam pelarut merupakan solute. Bentuk larutan berupa campuran homogen yang memiliki ukuran partikel yang sama dan tidak memiliki bidang batas antara zat pelarut dan terlarut. Larutan dapat mengalami tiga kondisi yaitu tak jenuh, jenuh, dan lewat yang ditandai dengan ada/tidaknya adanya endapan.
Bagaimana cara memperkirakan ion logam yang mengendap? Bagaimana cara mengetahui suatu reaksi akan menghasilkan endapan atau tidak? Sobat idschool dapat mencari tahu jawabannya melalui ulasan cara memperkirakan ion logam yang mengendap di bawah.
Table of Contents
3 Hubungan Antara Qsp dan Ksp Larutan
Perkiraan pengendapan dapat dilakukan dengan membandingan nilai hasil kali ion (Qc atau Qsp) dengan Kasp larutan. Ada 3 hubungan yang dapat terjadi antara Qsp dengan Ksp larutan yaitu lebih kecil (>), sama dengan (=), atau lebih besar (>). Ketiga hubungan tersebut dapat digunakan untuk mengetahui kondisi larutan apakah belum jenuh, tepat jenuh, atau lewat jenuh.
Jika Qsp lebih kecil dari Ksp larutan (Qsp < Ksp) maka larutan tak jenuh yang ditandai dengan tidak adanya endapan. Jika Qsp sama dengan Ksp larutan (Qsp = Ksp) maka larutan tepat jenuh yaitu kondisi saat larutan tepat akan membentuk endapan. Sedangkan jika Qsp lebih besar dari Ksp (Qsp > Ksp) maka larutan lewat jenuh yang ditandani dengan adanya endapan terbentuk.
Larutan tak jenuh:
Partikel-partikel dalam larutan tidak tepat habis bereaksi sehingga masih bisa melarutkan semua zat terlarut.
Larutan tepat jenuh:
Partikel-partikel dalam larutan tepat habis bereaksi dengan zat dengan konsentrasi maksimal (pereaksi), mengandung sejumlah solute yang larut dan mengadakan kesetimbangn dengan solute padatnya.
Larutan lewat jenuh:
Mengandung lebih banyak solute dari pada yang diperlukan untuk larutan jenuh sehingga tidak dapat lagi melarutkan zat terlarut hingga terbentuk endapan.
Baca Juga: Larutan (s) dan Hasil Kali Kelarutan (Ksp)
Cara Menghitung Qsp
Hasil kali kelarutan (Ksp) adalah banyaknya mol zat terlarut (s) pada saat larutan jenuh. Kelarutan sendiri merupakan jumlah maksimal dari suatu zat yang masih bisa larut dalam suatu senyawa. Nilai tetapan pada Ksp larutan diperoleh dari hasil kali konsentrasi ion-ion pada larutan jenuh yang telah dipangkatkan dengan koefisien dari persamaan ionisasi larutan tersebut.
Hasil kali konsentrasi ion-ion yang terurai setelah dipangkatkan dengan koefisien yang sesuai pada keadaan larutan tepat jenuh dinyatakan dalam nilai Ksp. Sedangkan hasil kali kelarutan pada keadaan yang belum dipastikan jenuh atau tidaknya dinyatakan dengan nilai Qsp atau Qc. Sehingga dapat disimpulkan bahwa Ksp merupakan tetapan kalarutan suatu zat dalam air. Sedangkan untuk hasil kali kelarutan disimbolkan dengan Qsp (Qc).
Nilai Qsp dapat dihitung melalui hasil kali konsentrasi ion-ion dari suatu senyawa. Cara mendapatkan nilai Qsp ditunjukkan seperti pada penyelesaian contoh soal berikut.
Contoh soal:
Sebanyak 100 mL larutan CaCl2 0,02 M dicampur dengan 100 mL larutan NaOH 0,2 M. Tentukan Qsp dari Ca(OH)2!
Penyelesaian:
Qsp (CaOH)2 dapat dihitung dengan mengalikan konsentrasi ion Ca2+ dari larutan CaCl2 dan ion OH‒ dari NaOH yang dapati diketahui dari ionisasi dai perbandingan koefisien.

Menghitung nilai Qsp dari Ca(OH)2:
Qsp = [Ca2+][OH‒]2
Qsp = 10‒2 × (10‒1)2
Qsp = 10‒2 × 10‒2 = 10‒4
Selanjutnya, nilai Qsp diberikan
Baca Juga: Pemekatan/Pengenceran Larutan pada Pencampuran Larutan
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan bagaimana cara mengetahui ion logam yang mengendap. Sobat idschool dapat menggunakan pembahasan cara memperkirakan ion logam yang mengendap tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Perkiraan Ion Logam yang Mengendap
100 mL MgCl2 0,01 M dicampurkan dengan 100 mL larutan NaOH 0,02 M. Jika Ksp Mg(OH)2 = 10‒12 maka pernyataan yang benar mengenai campuran tersebut adalah ….
A. terbentuk endapan Mg(OH)2 karena Qsp < Ksp
B. terbentuk endapan Mg(OH)2 karena Qsp > Ksp
C. larutan tepat akan mengendap karena Qsp = Ksp
D. belum terbentuk endapan Mg(OH)2 karena Qsp < Ksp
E. belum terbentuk endapan Mg(OH)2 karena Qsp > Ksp
Pembahasan:
Pengendapan akan terjadi saat nilai Qsp campuran lebih besar dari Ksp larutan (Qsp > Ksp). Dari keterangan yang diberikan pada soal diketahui bahwa Ksp Mg(OH)2 = 10‒12. Selanjutnya, perlu dihitung nilai Qsp dari campuran MgCl2 dengan NaOH untuk mengetahui ada/tidaknya endapan pada campuran tersebut.
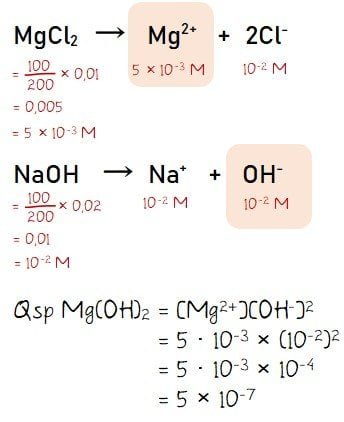
Dari hasil perhitungan diperoleh nilai Qsp Mg(OH)2 = 5 × 10-7 M dan diketahui Ksp Mg(OH)2 = 10-12. Sehingga dapat disimpulkan bahwa Qsp Mg(OH)2 > Ksp Mg(OH)2 yang berati telah trebentuk endapan Mg(OH)2.
Jadi, pernyataan yang benar mengenai campuran tersebut adalah terbentuk endapan Mg(OH)2 karena Qsp > Ksp.
Jawaban: B
Contoh 2 – Perkiran Ion Logam yang Mengendap
Suatu sampel batuan diketahui mengandung garam natrium, kalium, magnesium, barium, dan seng. Sampel ini dilarutkan secara sempurna dalam HCl pekat dan zat pengotor yang tidak larut dipisahkan melalui penyaringan. Jika ke dalam larutan hasil penyaringan ditambahkan KOH secara perlahan-lahan, ion logam yang mengendap sebagai padatan hidroksida adalah ….
A. Na
B. K
C. Mg
D. Ba
E. Zn
Pembahasan:
Untuk mengetahui ion mana yang akan mengendap dapat dilihat dari nilai Ksp kelarutan. Di mana, jika nilai kelarutan semakin kecil maka senyawa akan lebih mudah mengendap.
Selain itu, untuk mengetahu ion mana yang akan mengendap dapat juga dilakukan dengan melihat sifat basa yang dimiliki, apakah basa kuat atau basa lemah. Senyawa dengan sifat basa kuat cenderung lebih mudah larut sehingga tidak mudah (sukar) mengendap. Sedangkan senyawa dengan sifat basa lemah cenderung sukar larut sehingga mudah mengendap.
Basa Kuat: mudah larut → sukar mengendap
Contoh senyawa: NaOH, KOH, Ba(OH)2
Basa Lemah: sukar larut → mudah mengendap
Contoh senyawa: Mg(OH)2, Zn(OH)2.
Antara Mg(OH)2 dan Zn(OH)2 sama-sama merupakan basa lemah, sehingga perlu melihat jenis logam dari senyawa tersebut. Diketahui Mg termasuk logam utama, sedangkan Zn merupakan logam golongan transisi. Di mana, logam transisi pada umumnya akan lebih mumdah mengendap. Sehingga dapat disimpulkan ion logam yang mengendap adalah senyawa dengan logam golongan transisi yaitu Zn(OH)2.
Jadi, ion logam yang mengendap sebagai padatan hidroksida adalah Zn (seng).
Jawaban: E
Contoh 3 – Perkiraan Ion Logam yang Mengendap
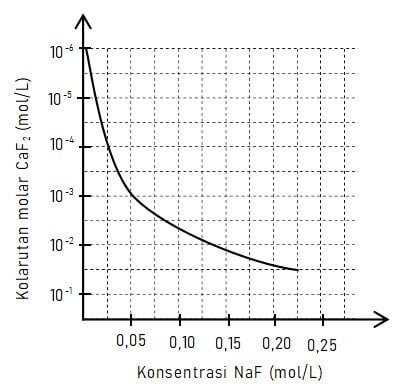
Sebanyak 0,1 gram padatan CaF2 (Mr CaF2 = 78) dilarutkan dalam 1 L air pada suhu 25 oC. Pada suhu tersebut, kurva kelarutan CaF2 sebagai fungsi konsentrasi NaF diberikan pada gambar di bawah.
Jika ke dalam larutan ditambahkan 0,05 mol NaF maka massa padatan CaF2 yang mengendap adalah ….
A. 78 mg
B. 50 mg
C. 39 mg
D. 22 mg
E. 0 mg
Pembahasan:
Dari gambar kurva yang diberikan dapat diketahui bawah kelarutan CaF2 saat konsentrasi NaF 0,05 mol/L adalah 10‒3. Sehingga massa CaF2 yang larut dapat ddihitung seperti penyelesaian pada cara berikut.

Dari hasil perhitungan diperoleh bahwa massa CaF2 yang larut sama dengan 78 ng. Dari soal, diketahui bahwa padatan CaF2 mula-mula yang dilarutkan sebanyak 0,1 gram = 100 mg. Jadi, massa padatan CaF2 yang mengendap sama dengan 100 ‒ 78 = 22 mg.
Jawaban: D
Demikianlah tadi ulasan cara memperkirakan ion logam yang mengendap beserta dengan contoh soalnya. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Rumus pH dan pOH Larutan