Isotop Isobar Isoton adalah bahasan tentang atom yang memiliki suatu kriteria tertentu. Kriteria tersebut dilihat berdasarkan nomor atom, nomor massa, atau jumlah neutron. Nomor atom menunjukkan jumlah proton yang terdapat pada suatu atom. Sedangkan nomor massa ditentukan oleh jumlah proton dan neutron, di mana nomor massa = proton + neutron. Umumnya, jumlah neutron dalam inti suatu atom sama dengan jumlah protonnya. Namun, pada beberapa atom memiliki jumlah neutron yang tidak sama dengan jumlah protonnya. Kondisi menjadikan sebuah atom atau lebih memiliki karakterisitik yang dapat disebut isotop, isobar, atau isoton.
Materi isotop isobar isoton membahas suatu atom dengan tiga kriteria berbeda. Pertama yaitu unsur dengan nomor atom sama tetapi memiliki nomor massa yang berbeda, contohnya atom oksigen (O). Kedua adalah unsur dengan nomor atom berbeda tetapi memiliki nomor massa yang sama, contohnya adalah atom Magnesium (Mg) dan atom Natrium (Na). Kondisi ketiga adalah dua atom berbeda namun memiliki jumlah neutron yang sama, contohnya karbon dan nitrogen.

Lambang suatu atom seperti di atas diberikan bersama dengan nomor massa dan nomor atom. Bilangan yang ditulis kecil pada bagian atas menunjukkan nomor massa suatu atom. Sedangkan bilangan yang ditulis kecil pada bagian bawah menunjukkan nomor atom dari suatu atom. Sobat idschool dapat mempelajari lebih lanjut mengenai Struktur Atom yang menjelaskan hubungan antara proton, neutron, dan elektron dengan nomor massa dan nomor atom.
Selanjutnya apa itu isotop? Apa itu isobar dan isoton? Bagaimana karakteristik dari suatu atom yang merupakan isotop isobar isoton? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
Apa Itu Isotop?
Isotop adalah unsur – unsur sejenis yang memiliki nomor atom sama, tetapi memiliki massa atom berbeda. Atau dengan kata lain dapat juga dikatakan bahwa unsur-unsur sejenis yang memiliki jumlah proton sama tetapi jumlah neutron berbeda. Contoh atom yang termasuk isotop adalah Oksigen (O). Diketahui nomor atom oksigen adalah 8 dan Oksigen ditemukan dengan tiga nomor massa yang berbeda yaitu 16, 17, dan 18.
Selain Oksigen (O), beberapa atom dengan isotop antara lain Hidrogen (H), Helium (He), Karbon (C), Nitrogen (N), Belerang (Fe), Klorin (Cl), dan Besi (Fe). Di mana nomor atom dan nomor massa dari atom-atom tersebut dapat dilihat seperti gambar di bawah.
Baca Juga: Cara Menentukan Jumlah Proton, Elektron, dan Neutron dari Suatu Atom
Apa Itu Isobar?
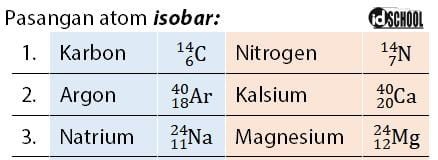
Isobar adalah atom dari unsur yang berbeda (mempunyai nomor atom berbeda) tetapi mempunyai nomor massa yang sama. Contoh atom yang termasuk isobar adalah atom atom Natrium (Na) dengan atom Magnesium (Mg). Diketahui bahwa nomor atom Natrium (Na) adalah 11, sedangkan nomor atom Magnesium (Mg) adalah 12. Kedua atom tersebut (Na dan Mg) sama-sama memiliki nomor massa sama dengan 24.
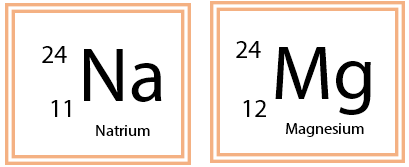
Selain Natrium dan Magnesiun, pasangan atom isobar juga terdapat pada atom karbon (C) dengan nitrogen (N) dan atom argon (Ar) dengan kalsium (Ca). Nomor atom karbon adalah 6 dan nomor atom nitrogen adalah 7, kedua atom tersebut memiliki nomor massa sama yaitu 14. Nomor atom argon adalah 18 dan nomor atom kalsium adalah 20, kedua atom tersebut memiliki nomor massa sama yaitu 40.
Baca Juga: Cara Menghitung Massa Atom Relatif (Ar) dan Molekul Relatif (Mr)
Apa Itu Isoton?
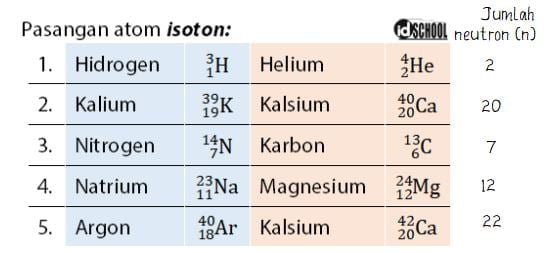
Isoton adalah atom dari unsur yang berbeda (mempunyai nomor atom berbeda) dan nomor massa yang berbeda (massa atom berbeda) tetapi mempunyai jumlah neutron sama. Sebagai contoh atom yang termasuk isoton adalah karbon (C) dan nitrogen (N). Atom karbon (C) diketahui memiliki nomor atom 6 dan nomor massa 13, jumlah neutronnya adalah 7. Dan atom nitrogen (N) memiliki nomor atom 7 dan nomor massa 7, jumlah neutronnya sama dengan 7.

Selain pasagan atom karbon (C) dan nitrogen (N), pasangan atom isoton terdapat juga pada atom hidrogen (H) – helium (He), kalium (K) – kalsium (Ca), natrium (Na) – Magnesium (Mg), serta Argon (Ar) – Kalsium (Ca). Di mana nomor massa, nomor atom, dan jumlah neutron dari pasangan-pasangan atom tersebut terdapat seperti pada daftar berikut.
Baca Juga: Cara Menentukan Golongan dan Periode pada Suatu Atom dari Konfigurasi Elektron
Contoh Soal Isotop Isobar Isoton (+Pembahasan)
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan isotop isobar isoton di atas. Setiap contoh soal isotop isobar isoton yang diberikan dilengkapi dengan pembahasan bagaimana cara mengenali atom dengan isotop isobar isoton. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Cara Menentukan Apakah Atom/Unsur Termasuk Isotop Isobar Isoton
Unsur X memiliki 10 proton dan 12 neutron, sedangkan unsur Y memiliki nomor massa 24 dan nomor atom 12. Kedua unsur itu termasuk ….
A. isoton
B. isotop
C. isobar
D. isomer
E. isotonic
Pembahasan:
Dari keterangan yang diberikan pada soal dapat diketahui jumlah proton dan neutron unsur X yaitu proton (p) = 10 dan neutron (n) = 12.
Menentukan jumlah proton dan neutron unsur Y:
nomor massa: A = 24
nomor atom = jumlah proton: p = 12
jumlah neutron = A − p = 24 − 12 = 12
Dari informasi yang didapat pada soal, jumlah neutron unsur X sama dengan jumlah neutron unsur Y yaitu sama dengan 12. Jumlah neutron sama merupakan kriteria untuk isoton. Jadi, kedua unsur tersebut termasuk isoton.
Jawaban: A
Contoh 2 – Soal Isotop Isobar Isoton
Jika suatu unsur Y mempunyai dua isotop 42Y dan 44Y dan massa atom relatifnya 43,7 maka perbandingan persentase kedua isotop tersebut di alam yaitu . . . .
A. 3 : 7
B. 3 : 17
C. 6 : 17
D. 17 : 3
E. 17 : 6
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut
- massa atom relatif Y: 43,7
- Unsur Y mempunya dua isotop: 42Y dan 44Y
Misalkan persentase dari 42Y = a % maka persentase 44Y = (100 − a)%. Sehingga dapat diperoleh persamaa massa atom relatif (Ar) rata-rata seperti berikut.

Dari perhitungan diperoleh bahwa persentase 42Y = a = 15%, sehingga persentase 44Y = 100 − a = 100% −15% = 85%. Jadi, persentase kedua isotop tersebut di alam adalah 42Y : 44Y = 15% : 85% = 3 : 17.
Jawaban: B
Sekian ulasan materi isotop isobar isoton, meliputi pengertian isotop, pengertian isobar, dan pengertian isoton. Dilengkapi juga contoh soal isotop isobar isoton yang dilengkapi dengan pembahasannya. Perbedaan isotop isobar isoton diringkas seperti pada cara berikut agar memudahkan dalam mengingatnya.

Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Perkembangan Teori Atom