Penyetaraan reaksi kimia adalah proses membuat reaksi kimia memiliki jumlah atom yang sama antara sebelum dan setelah reaksi. Inti dari penyetaraan reaksi kimia adalah membuat ruas kiri dan ruas kanan dari reaksi kimia memiliki jumlah atom sama untuk setiap jenisnya. Caranya adalah dengan menambahkan koefisien yang sesuai di depan senyawa atau zat-zat yang terlibat.
Persamaan kimia memuat rumus kimia zat-zat pereaksi dan hasil reaksi yang disertai koefisien dan fase masing-masing senyawa. Zat-zat peraksi disebut juga dengan reaktan, sedangkan hasil reaksi disebut dengan produk. Antara pereaksi/reaktan dengan produk (hasil reaksi) dipisahkan oleh tanda panah ke kanan (→). Simbol panah pada reaksi kimia dibaca dengan membentuk atau bereaksi menjadi.
Misalnya reaksi gas hidrogen (H2) dan gas oksigen (O2) membentuk air (H2O). Pada reaksi kimia tersebut, gas hidrogan dan oksigen adalah reaktan atau pereaksi. Sedangkan air adalah hasil reaksi produk yang dihasilkan dari reaksi yang terjadi.
Penyetaraan reaksi kimia untuk reaksi gas hidrogen dan oksigen yang membentuk air (H2O) adalah H2 (g) + O2 (g) → H2O (l).

Pada persamaan reaksi kimia di atas terdapat koefisien reaksi yang diletakkan di depan senyawa air (H2O). Adanya koefisien reaksi tersebut membuat persamaan reaksi kimia menjadi setara antara ruas kiri (reaktan) dan kanan (produk).
Keberadaan koefisien reaksi yang dihasilkan dari proses penyetaraan reaksi kimia berguna untuk mengetahui massa produk yang dihasilkan dalam reaksi. Bagaimana cara mendapatkan persamaan reaksi yang setara? Bagaimana penggunaan penyetaraan reaksi kimia? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Baca Juga: Konsep Mol pada Perhitungan Kimia
Cara Mendapatkan Reaksi Kimia yang Setara
Proses yang terjadi pada reaksi kimia adalah mengubah zat-zat asal (reakstan/pereaksi) menjadi suatu zat baru (produk atau hasil reaksi). Namun pada reaksi kimia tidak merubah jenis dan jumlah atom yang terlibat dalam reaksi. Perubahan yang terjadi pada suatu reaksi terdapat pada ikatan kimia. Di mana, ikatan kimia pada senyawa pereaksi putus dan terbentuk ikatan baru dalam produknya.
Persamaan reaksi menyatakan kesetaraan jumlah zat-zat yang bereaksi dengan jumlah zat-zat hasil reaksi. Pada penyetaraan reaksi kimia melibatkan rumus kimia zat-zat yang terlibat, koefisien reaksi, dan wujud zat.
Langkah-langkah penyetaraan reaksi kimia:
Ada beberapa langkah yang perlu dilakukan untuk melakukan penyetaraan reaksi kimia. Berikut ini adalah langkah-langkah yang dilakukan dalam penyetaraan reaksi kimia.
- Menuliskan persamaan reaksi
- Menentukan satu senyawa/zat yang diberi koefisien = 1 [tips: pilih senyawa/zat dengan rumus kimia paling kompleks/rumit]
- Beri koefisien pemisalan dengan huruf seperti a, b, c, dan seterusnya pada setiap zat selain zat yang dipilih pada nomor 2
- Menghitung jumlah atom di ruas kiri dan kanan
- Menentukan nilai a, b, c, dan lain sebagainya
- Menuliskan ulang reaksi kimia beserta koefisien-koefisien yang diperoleh
Sebagai contoh, sobat idschool dapat mencari tahu bagaimana cara penyetaran reaksi kimia berikut.
Contoh cara penyetaraan reaksi kimia
Soal:
Setarakan reaksi kimia pada besi (Fe) dan oksigen (O2) yang menghasilkan Fe2O3!
Penyelesaian:
Penyetaraan reaksi kimia untuk rektan besi dan oksigen dengan produk Besi (III) Oksida dilakukan seperti cara di bawah.

Baca Juga: Rumus Molekul Senyawa
Penggunaan Persamaan Reaksi Kimia yang Setara
Berdasarkan hukum perbandingan volume (Hukum Gay-Lussac) menerangkan bahwa perbandingan volume gas-gas pada tekanan (P) dan suhu (T) yang sama adalah bilangan bulat sederhana. Sehingga, perbandingan koefisien menyatakan perbandingan jumlah partikel dan perbandingan mol.
Proses penyetaraan reaksi kimia menghasilkan koefisien-koefisien di depan rumus zat-zat kimia. Keberadaan koefisien reaksi pada suatu persamaan reaksi kimia mewakili perbandingan jumlah mol dari zat yang terlibat dalam reaksi.
Misalkan pada reaksi kimia 4 Fe (s) + 3 O2 (g) → 2 Fe2O3 (s) digunakan 0,5 mol Fe dan 2 mol gas oksigen (O2). Hasil reaksi Fe2O3 yang akan terbentuk dapat diketahui melalui perbandingan koefisien pada reaksi setara tersebut.
Sebelumnya, sobat idschool perlu mengetahui apa itu pereaksi pembatas. Dikutip dari wikipedia, bahwa Pereaksi pembatas adalah pereaksi yang terdapat dalam jumlah yang relatif terkecil (dalam hubungan stoikiometrisnya). Pereaksi pembatas akan habis bereaksi, sedang perekasi-pereaksi yang lain akan meninggalkan sisa.
Pereaksi pembatas ditentukan dari jumlah mol mula-mula dibagi koefisien zat masing-masing. Selanjutnya, jumlah mol pada pereaksi pembatas menjadi patokan pada perhitungan jumlah mol yang bereaksi. Untuk lebih jelasnya dapat diperhatikan contoh berikut.

Dari hasil perhitungan menunjukan bahwa untuk 0,5 mol Fe dan 2 mol O2 akan membentuk 0,2 mol Fe2O3. Selanjutnya jumlah mol dapat digunakan untuk menghitung massa, jumlah partikel, dan lain sebagainya.
Baca Juga: Cara Menghitung Massa Atom Relatif (Ar) dan Massa Molekul Relatif (Mr)
Contoh Soal dan Pembahasan
Beberapa contoh soal dibawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Penyetaraan Reaksi Kimia
Aluminium bereaksi dengan asam sulfat membentuk aluminium sulfat dan gas hidrogen. Persamaan reaksi yang benar untuk proses tersebut adalah ….
A. Al2 + 3H2SO4 → AL2(SO4)3 + 6H2
B. 2Al + H2SO4 → Al2SO4 + H2
C. Al + H2SO4 → AlSO4 + H2
D. 3Al + 2H2SO4 → Al(SO4)2 + 2H2
E. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Pembahasan:
Persamaan reaksi kimia untu Aluminium (Al) bereaksi dengan asam sulfat (H2SO4) membentuk Aluminium sulfat (Al2(SO4)3) dan gas Hidrogen (H2): AI + H2SO4 → Al2(SO4)3 + H2
Namun, persamaan reaksi kimia AI + H2SO4 → Al2(SO4)3 + H2 belum setara. Penyetaraan reaksi kimia tersebut dapat dilakukan seperti cara di bawah.

Dari hasil penyetaraan reaksi diperoleh beberapa persamaan:
a = 2
2b = 2c
b = 3
4b = 12
Dari persamaan di bawah dapat diperoleh bahwa nilai a = 2 dan b = 3. Selanjutnya, akan ditentukan nilai c untuk mendapat reaksi kimia yang setera.
Menentukan nilai c:
2c = 2b
c = b = 3
Substitusi nilai a = 2, b = 3, dan c = 3 yang diperoleh pada persamaan reaksi kimia bagian awal.
a AI + b H2SO4 → 1 Al2(SO4)3 + c H2
2AI + 3H2SO4 → Al2(SO4)3 + 3H2
Jadi, persamaan reaksi yang benar untuk proses tersebut adalah
2Al + 3H2SO4 → Al2(SO4)3 + 3H2.
Jawaban: E
Contoh 2 – Soal Penyetaraan Reaksi Kimia
Sebanyak 100 mℓ larutan Pb(NO3)2 0,2 M direaksikan dengan 100 mℓ larutan KI 0,2 M menurut reaksi:
Pb(NO3)2 (aq) + 2 KI (aq) → PbI2 (s) + 2 KNO3 (aq)
Maka banyaknya endapan PbI2 yang dihasilkan adalah ….
A. 5 mmol
B. 10 mmol
C. 15 mmol
D. 20 mmol
E. 25 mmol
Pembahasan:
Jumlah mol untuk 100 mℓ larutan Pb(NO3)2 0,2 M:
n = M × V
= 0,2 × 100
= 20 mmol
Jumlah mol untuk 100 mℓ larutan KI 0,2 M:
n = M × V
= 0,2 × 100
= 20 mmol
Bentuk persamaan Pb(NO3)2 (aq) + 2 KI (aq) → PbI2 (s) + 2 KNO3 (aq) merupakan reaksi yang setara. Persamaan tersebut dapat digunakan untuk menentukan banyaknya endapan PbI2 yang dihasilkan.
Dari persamaan reaksi kimia yang sudah setara tersebut dapat diperoleh perbandingan mol untuk kalsium hidroksida.

Jadi, banyaknya endapan PbI2 yang dihasilkan adalah 10 mmol.
Jawaban: B
Contoh 3 – Soal Penyetaraan Reaksi Kimia
Karbit (CaC2) dilarutkan dalam air dan menghasillkan kalsium hidroksida dan gas Asitelena (C2H2). Jika 2 mol karbit direaksikan dengan 2 mol air maka jumlah massa kalsium hidroksida yang terbentuk adalah ….
(Ar Ca = 40; O = 16; H = 1; C = 12)
A. 26 gram
B. 74 gram
C. 100 gram
D. 182 gram
E. 190 gram
Pembahasan:
Langkah pertama yang perlu dilakukan adalah membuat persamaan reaksi. Kalsium hidroksida terdiri dari ion kalsium (Ca2+) yang berikatan dengan ion poliatom hidroksida (OH‒). Rumus senyawa yang terbentuk dari kedua ion tersebut adalah Ca(OH)2 .
Persamaan untuk karbit (CaC2) dan H2O (air) menghasillkan Ca(OH)2 dan C2H2:
CaC2 (s) + H2O (l) → Ca(OH)2 (aq) + C2H2 (g)
Penyetaraan reaksi kimia:
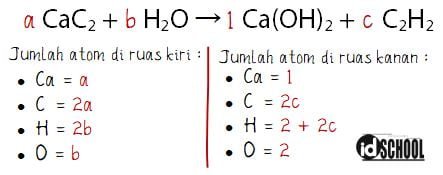
Sehingga diperoleh nilai untuk a = 1 dan b = 2, sedangkan nilai 2c = 2a → c = a = 1. Diperoleh persamaan reaksi kimia yang setara seperti berikut.
a CaC2 (s) + b H2O (l) → 1 Ca(OH)2 (aq) + c C2H2 (g)
1 CaC2 (s) + 2 H2O (l) → 1 Ca(OH)2 (aq) + 1 C2H2 (g)
Dari persamaan reaksi kimia yang sudah setara tersebut dapat diperoleh perbandingan mol untuk kalsium hidroksida.

Diperoleh banyak mol Ca(OH)2 (kalsium hidroksida) yang terbentuk adalah 1 mol. Selanjuntya, massa kalsium hidroksida yang dibentuk dapat diperoleh melalui perhitungan di bawah.
Massa Ca(OH)2 = mol × Mr Ca(OH)2
= 1 × (40+2×16+2×1)
= 74 gram
Jawaban: B
Demikianlah tadi ulasan penyetaraan reaksi kimia, terima kasih sudah mengunjungi idschool(dot)net. Semoga bermanfaat!
Baca Juga: [Praktikum Kimia] Hubungan Koefisien Reaksi dan Jumlah Mol Reaktan
