Proses yang terjadi pada sel elektrolisis adalah perubahan energi listrik menjadi energi kimia. Perhitungan sel elektrolisis memungkinkan untuk mengetahui berapa banyak pengendapan ion logam yang terjadi. Atau, perhitungan sel elektrolisis juga dapat digunakan untuk menentukan berapa arus listrik yang dibutuhkan dalam rangkaian sel elektrolisis. Dasar dari perhitungan sel elektrolisis adalah bunyi Hukum Faraday I dan Hukum Faraday II.
Bagaimana cara perhitungan sel elektrolisis untuk mengetahui banyak pengendapan ion logam? Bagaimana perhitungan sel elektrolisis untuk mengetahui besar arus listrik yang dsibutuhkan? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Hukum Faraday I dan II
- Contoh Penggunaan Rumus Hukum Faraday pada Perhitungan Sel Elektrolisis
- Contoh Soal dan Pembahasan
Hukum Faraday I dan II
Michael Faraday mengungkap fakta bahwa terdapat hubungan antara banyaknya perubahan kimia dan besar arus listrik. Di mana, banyaknya perubahan kimia yang dihasilkan oleh arus listrik sebanding dengan jumlah listrik yang mengalir. Hubungan antara perubahan kimia dan arus listrik kemudian dinyatakan dalam Hukum Faraday.
Ada 2 hukum yang menjelaskan mengenai hubungan perubahan kimia yang terjadi dan besar arus listrik. Dua hukum tersebut adalah Hukum I Faraday dan Hukum II Faraday.
Bunyi Hukum I Faraday:
Jumlah massa zat yang dihasilkan pada katoda dan anoda berbanding lurus dengan jumlah listrik yang digunakan selama elektrolisis.
Secara matematis, bunyi Hukum Faraday I dapat dirumuskan ke persamaan m = e × F. Di mana: m = massa, e = massa ekivalen, dan F = Faraday. Besar satu Faraday (1 F) sama dengan satu mol elektron atau sama dengan 96.500 coulomb.
Penurunan rumus sesuai dengan Hukum Faraday I dapat menghasilkan beberapa persamaan seperti berikut.
Bunyi Hukum II Faraday:
Apabila dua sel atau lebih dialiri listrik dalam jumlah yang sama maka massa zat-zat (m) yang dihasilkan sedanding dengan massa ekivalen (e) zat-zat tersebut.
Baca Juga: Diagram Sel Volta dan Reaksi yang Terjadi
Contoh Penggunaan Rumus Hukum Faraday pada Perhitungan Sel Elektrolisis
Dua buah persoalan di bawah dapat diselesaikan dengan hukum Faraday. Sobat idschool dapat mencermati bagaimana penggunaan rumus Hukum Faraday pada perhitungan sel elektrolisis melalui penyelsaian soal-soal berikut.
Soal 1:
Reaksi Cu2+ + 2e → Cu melibatkan arus listrik 965 A selama 10 detik. Tentukan massa Cu yang terbentuk jika Ar Cu = 63,5!
Penyelesaian:
Untuk menghitung masa Cu membutuhkan informasi arus listrik (i), massa ekivalen (e), dan waktu (t). Ketiga besaran tersebut dapat diperoleh dari keterangan yang diberikan pada soal.
- Arus listrik: i = 965 A
- Waktu: t = 10 detik
- Massa ekivalen: e = Ar Cu/val. = 63,5/2 = 31,75
Selanjutnya, massa Cu yang terbentuk dapat dihitung seperti pada penyelesaian berikut.
Soal 2:
Arus yang sama dialirkan ke dalam larutan CuSO4 dan larutan NiSO4. Bila massa Cu yang mengendap 6,35 gram, massa Ni yang mengendap adalah …. (Ar Cu = 63,5; Ni = 59)
Penyelesaian:
Pertama adalah menentukan nilai massa ekivalen atau valensi dari Cu dan Ni seperti cara berikut.
Ionisasi:
CuSO4 → Cu2+ + SO42‒
NiSO4 → Ni2+ + SO42‒
Sehingga diperoleh valensi Cu = 2 dan valensi Ni = 2
Selanjutnya, persoalan seperti pada soal 2 dapat diselesaikan dengan Hukum Faraday II, seperti yang ditunjukkan pada cara berikut.

Baca Juga: Cara Membedakan Larutan Elektrolit Kuat dan Elektrolit Lemah
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan perhitungan sel elektrolisis di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan perhitungan sel elektrolisis. Sobat idschool dapat menggunakan pembahasan perhitungan sel elektrolisis tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Perhitungan Sel Elektrolisis
Massa logam perak yang diendapkan jika arus listrik sebesar 5 ampere dialirkan ke dalam larutan AgNO3 selama 2 jam adalah …. (Ar Ag = 108)
A. 24,90 gram
B. 29,40 gram
C. 40,29 gram
D. 42,09 gram
E. 49,20 gram
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Besar arus listrik: i = 5 A
- Waktu: t = 2 jam = 7.200 detik
- Larutan AgNO3
- Ar Ag = 108
Menentukan valensi dari Ag:
AgNO3 → Ag+ + NO3‒
Diketahui bahwa muatan Ag+ = +1, sehingga valensi atau val. = 1
Menghitung massa ekivalen (e) logam perak:
e = Ar Ag/val.
e = 108/1 = 108
Menghitung massa Ag yang mengendap (W):
Jadi, massa Ag yang diendapkan adalah 40,29 gram.
Jawaban: C
Contoh 2 – Perhitungan Sel Elektrolisis
Kunci yang terbuat dari besi akan disepuh dengan logam emas menggunakan kuat arus 10 ampere selama 9.650 detik, seperti gambar berikut.
Pada reaksi penyepuhan kunci besi dengan logam emas diperlukan arus listrik 0,015 Faraday, massa logam emas yang melapisi kunci besi tersebut adalah …. (Ar Au = 197)
A. 0,0985 gram
B. 0,2985 gram
C. 0,9850 gram
D. 2,9850 gram
E. 9,8600 gram
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh beberapa informasi yang dibutuhkan seperti berikut.
- Arus listrik yang dibutuhkan: i = 0,015 Faraday
- Massa atom relatif emas: Ar Au = 197
- Muatan Au = +3 → valensi = 3
Menghitung massa logam emas yang mengendap:
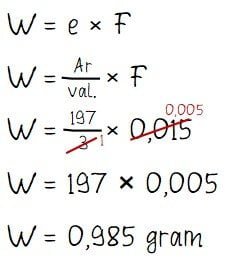
Jadi, massa logam emas yang melapisi kunci besi tersebut adalah 0,9850 gram.
Jawaban: C
Contoh 3 – Perhitungan Sel Elektrolisis
Pada elektrolisis satu liter larutan ZnSO4 dengan sejumlah arus tertentu selama 965 detik, dihasilkan larutan pada anode dengan pH = 2 ‒ log 2. Besarnya arus listrik yang dibutuhkan sama dengan ….
A. 0,5 A
B. 1 A
C. 1,5 A
D. 2 A
E. 3 A
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh beberapa informasi yang dibutuhkan seperti berikut.
- Volume larutan ZnSO4: 1 liter
- Waktu: t = 965 detik
- pH = 2 ‒ log 2 (pada anoda) → [H+] = 2×10‒2 M
Reaksi elektrolisis untuk larutan ZnSO4: ZnSO4 → Zn2+ + SO42‒
Reaksi pada anoda: 2H2O → O2 + 4H+ + 4e
Diketahui bahwa [H+] pada larutan adalah 2×10‒2 M sehingga mol dari H+ dapat dihitung melalui cara berikut.
mol = M × V
mol = 2×10‒2 M × 1 L
mol = 2×10‒2 = 0,02
Perhatikan bahwa koefisien H+ dan elektron (e) adalah sama, jadi mol elektron = mol H+ = 0,02 mol. Selanjutnya, mol elektron dapat digunakan untuk menghitung besar arus listrik seperti yang ditunjukkan pada cara berikut.

Jadi, arus yang dibutuhkan adalah 2 ampere.
Jawaban: D
Demikianlah tadi ulasan perhitungan sel elektrolisis untuk pengendapan ion logam. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: 4 Bentuk Rumus Usaha dalam Termodinamika



