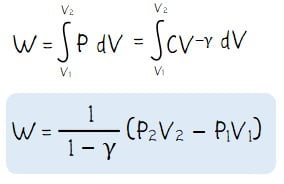Termodinamika adalah cabang Fisika yang mempelajari hukum-hukum dasar tentang kalor dan usaha. Cakupan bahasan dalam termodinamika mempelajari perubahan energi panas menjadi energi gerak, begitu juga dengan proses sebaliknya. Ada 4 jenis proses termodinamika yaitu isobarik isokhorik isotermik dan adibatik. Keempat jenis proses termodinamika tersebut dibedakan berdasarkan perubahan volume, tekanan, atau suhu suatu gas dalam ruang tertutup.
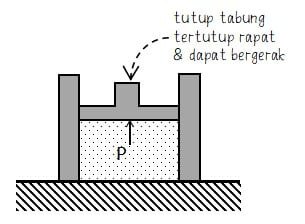
Sebuah tabung berisi gas terpasang dengan penutup rapat yang dapat digeser (gaya gesek antara tabung dan penutup diabaikan). Tutup tabung yang digerakkan akan membuat gas di dalam tabung memiliki perubahan volume, tekanan, atau keduanya. Tekanan gas timbul karena adanya pergerakan molekul-molekul gas. Perubahan tekanan (P) akan diikuti dengan perubahan volume (V), suhu (T), atau keduanya.
Baca Juga: Rumus Energi Kinetik Gas Ideal
Gas dalam ruang tertutup dapat mengalami beberapa proses yaitu proses isobarik isokhorik isotermik dan proses adiabatik. Proses termodinamika dapat direpresentasikan pada diagram tekanan (P) -volume (V) dengan temperatur/suhu melalui diagram entropi.
Apa itu proses isobarik isokhorik isotermik? Bagaimana proses termodinamika yang disebut dengan adiabatik? Bagaimana bentuk diagram entropi pada proses isobarik isokhorik isotermik dan proses adiabatik? Sobat idschool dapat mencari tahu jawabannya melalui ulasan proses termodinamika yang meliputi isobarik isokhorik isotermik dan adibatik di bawah.
Table of Contents
- Proses Isobarik (Tekanan Tetap)
- Proses Isokhorik (Volume Tetap)
- Proses Isotermik/Isotermal (Suhu Tetap)
- Proses Adiabatik (Tidak Ada Perpindahan Kalor Antara Sistem dan Lingkungan)
- Contoh Soal Isobarik Isokhorik Isotermik dan Proses Adibatik (+Pembahasan)
Proses Isobarik (Tekanan Tetap)
Kata isobarik berasal dari Bahasa Yunani yaitu Iso berati sama dan Baros berarti tekanan. Sehingga dapat dikatakan bahwa, proses isobarik adalah proses yang berlangsung pada tekanan tetap. Pada proses isobarik, tekanan konstan diperoleh ketika volume diperbesar atau diperkecil. Contoh proses isobarik terdapat pada proses perebusan air menjadi uap atau pembekuan air menjadi es.
Sebuah proses isobarik dapat juga dikatakan sebagai proses tekanan konstan. Persamaan yang sesuai dengan proses isobarik adalah P1 = P2. Di mana P1 adalah tekanan sebelum dan P2 adalah tekanan setelah proses.
Sebuah gas yang dipanaskan dalam tabung akan memuai dan mendorong tutup tabung ke atas karena volume gas bertambah. Volume gas bertambah terjadi pada gas yang melakukan usaha atau usaha gas positif (proses ekspansi).
Sedangkan pada proses pendinginan gas akan membuat tutup akan turun karena volume gas berkurang. Volume gas berkurang terjadi pada peristiwa gas dilakukan usaha atau usaha gas negatif (proses kompresi).
Proses isobarik ditunjukkan pada diagram P ‒ V sebagai garis horizontal (mendatar). Untuk semua proses gas ideal, usaha yang dilakukan sama dengan luas daerah dibawah grafik P ‒ V. Besar usaha yang dilakukan oleh gas pada proses isobarik dapat dihitung melalui persamaan W = P × ΔV atau W = P × (V2 ‒ V1).
Grafik P ‒ V pada proses isokorik sesuai dengan gambar berikut.
Baca Juga: Persamaan Umum Gas Ideal
Proses Isokhorik (Volume Tetap)
Istilah isokhorik berasal dari Bahasa Yunani yaitu iso yang berarti sama dan choric yang berarti ruang/volume. Sehingga dapat diartikan bahwa isokhorik adalah suatu proses yang dialami oleh gas di mana gas tidak mengalami perubahan volume. Dengan kata lain, proses isokhorik adalah proses yang terjadi pada sistem dengan volume tetap (ΔV = 0). Proses isokhorik sering juga disebut dengan proses isometrik atau proses volume konstan.
Nilai volume yang tidak mengalami perubahan akan membuat besar usaha sama dengan nol. Kondisi ini sesuai dengan persamaan usaha pada proses isokorik yaitu (W = P × ΔV = P × 0 = 0). Bagaimana perubahan tekanan yang terjadi (positif atau negatif), usaha yang dilakukan oleh gas dalam proses isokhorik adalah nol (W = 0).
Grafik P ‒ V pada proses isokhorik sesuai dengan gambar berikut.
Baca Juga: Rumus Besar Usaha dan Efisiensi Mesin Carnot
Proses Isotermik/Isotermal (Suhu Tetap)
Proses isotermal atau isotermik adalah proses yang berlangsung pada suhu yang tetap, sedangkan parameter lain dalam sistem dapat berubah menyesuaikan kondisi. Contoh peristiwa isotermik terjadi pada peristiwa membawa masuk/keluar panas dari/keluar rumah dengan tujuan agar mendapatkan rumah dengan kondisi yang diinginkan. Dalam dunia industri, peristiwa isotermik terdapat pada mesin Carnot dan cara kerja lemari es (kulkas).
Perkalian antara tekanan (P) dan volune (V) pada gas ideal adalah konstan, pernyataann tersebut dikenal dengan Hukum Boyle. Sehingga dapat diperoleh persamaan yang berlaku pada proses isotermik yaitu P × V = konstan atau P1 × V1 = P2 × V2.
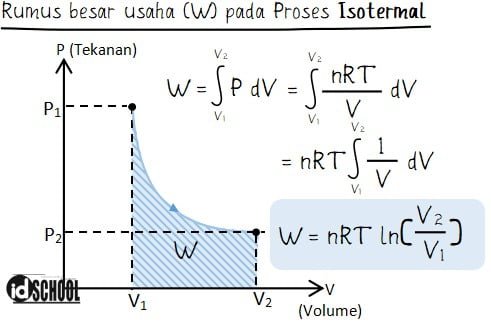
Grafik hubungan tekanan (P) dan volume (V) pada proses isotermik sesuai dengan gambar berikut.
Berdasarkan persamaan perubahan energi dalam yaitu ΔU = Q ‒ W, didapatkan bahwa usaha yang dilakukan sama dengan jumlah kalor yang diberikan. Karena suhunya tetap maka pada proses isotermis ini tidak terjadi perubahan energi dalam atau ΔU = 0.
Sehingga, pada proses isotermik berlaku persamaan berikut:
ΔU = 0
Q ‒ W = 0
Q = W
Q = W
Persamaan pada proses isotermal
Besar usaha yang dilakukan gas pada proses isotermik tidak dapat dihitung dengan persamaan W = P × ΔV karena tekanan tidak konstan. Namun, dapat diselesaikan dengan menghitung luas dibawah grafik dengan integral sehingga diperoleh persamaan berikut.
Baca Juga: Persamaan Bernoulli
Proses Adiabatik (Tidak Ada Perpindahan Kalor Antara Sistem dan Lingkungan)
Adiabatik adalah proses di mana tidak terjadi perpindahan kalor baik ke dalam ataupun keluar sistem (ΔQ = 0). Perbedaan proses adiabatik dan isotermik/isotermal terdapat pada ada/tidaknya pengaruh lingkungan dalam proses menerima atau melepaskan kalor.
Contoh proses adiabatik terdapat pada termos yang memuat air panas. Prinsip kerja termos menggunakan bahan yang bersifat adiabatik yang secara ideal dapat menghambat atau tidak memungkinkan terjadinya reaksi antara sistem dan lingkungan. Tidak adanya interaksi antara sistem dan lingkungan akan mengakibatkan perpindahan kalor menjadi tidak ada sehingga tidak terjadi pertukaran suhu.
Dengan menggunakan bahan adiabatik, termos mampu mempertahankan suhu air yang berada di dalamnya. Suhu dalam sistem pada proses adiabatik ini tidak tetap walaupun tidak ada kalor yang masuk atau keluar. Proses adiabatik dapat dilakukan dengan cara menutup sistem serapat-rapatnya sehingga tidak ada pertukaran kalor dengan lingkungan.
Tidak adanya kalor yang masuk/keluar sistem maka pada proses adiabatik memenuhi persamaan ΔQ = 0. Sehingga, proses adiatik memenuhi persamaan ΔU = Q ‒ W = 0 ‒ W = ‒W (ΔU = ‒W).
Pada proses adiabatik berlaku rumus Poison yaitu PVγ = konstan. Di mana P adalah tekanan, V = volume, dan γ adalah tetapan Laplace. Persamaan dalam tetapan laplace (γ) sama dengan perbandingan antara kalor jenis gas pada tekanan tetap (Cp) dan kalor jenis gas pada volume tetap.
Grafik hubungan tekanan (P) dan volume (V) pada proses adiabatik sesuai dengan gambar berikut.
Sedangkan besar usaha pada proses adiabatik dapat dicari melalui persamaan berikut.
Keterangan:
W = usaha
P = tekanan
V = volume gas
γ = tetapan Laplace
Baca Juga: 4 Hukum Tentang Gas dan Persamaannya
Contoh Soal Isobarik Isokhorik Isotermik dan Proses Adibatik (+Pembahasan)
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menabah pemahaman bahasan isobarik isokhorik isotermik dan adiabatik. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan isobarik isokhorik isotermik dan adiabatik. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Soal Proses Isobarik Isokhorik Isotermik dan Adiabatik
Diagram P ‒ V dari gas helium yang mengalami proses termodinamika ditunjukkan seperti gambar berikut!

Usaha yang dilakukan gas helium pada prose ABC sebasar ….
A. 660 kJ
B. 400 kJ
C. 280 kJ
D. 120 kJ
E. 60 kJ
Pembahasan:
Grafik Pada soal menunjukkan terjadinya proses isokhorik (garis vertikal) dan proses isobarik (garis horizontal). Beberapa keterangan yang diberikan pada soal antara lain meliputi informasi-informasi berikut.
- Volume gas di titik A dan B: V₁ = 1,5 m³
- Volume gas di titik C: V₃ = 3,5 m³
- Tekanan gas di titik A: P₁ = 4 × 10⁵ Pa
- Tekanan gas di titik B dan C: P₂ = 2 × 10⁵ Pa
Pertama, cari usaha yang dilakukan gas pada proses AB:
Grafik yang diberikan pada proses AB menunjukkan bahwa terjadi proses isokhorik. Pada proses isokhorik ditandai dengan sistem dengan volume tetap sehingga besar usaha yang dilakukan sama dengan nol (WAB = 0).
Kedua, cari usaha yang dilakukan gas pada proses BC:
Grafik pada proses BC berupa grafik horizontal yang menunjukkan terjadinya proses isobarik. Besar usaha yang dilakukan pada proses BC dapat dihitung seperti pada cara berikut.
Menghitung besar usaha pada proses BC:
W = PB/c × ΔV
WBC = PB/c × (VC ‒ VB)
WBC = 2 × 10⁵ × (3,5 ‒ 1,5)
WBC = 2 × 10⁵ × 2
WBC = 4 × 10⁵ joule
Menghitung total usaha pada proses ABC:
Wtotal = WAB + WBC
Wtotal = 0 + 4 × 10⁵ joule
Wtotal = 400.000 joule = 400 kJ
Jadi, usaha yang dilakukan gas helium pada prose ABC sebasar 400 kJ
Jawaban: B
Contoh 2 – Soal Proses Termodinamika (Isobarik Isokhorik Isotermik dan Adiabatik)
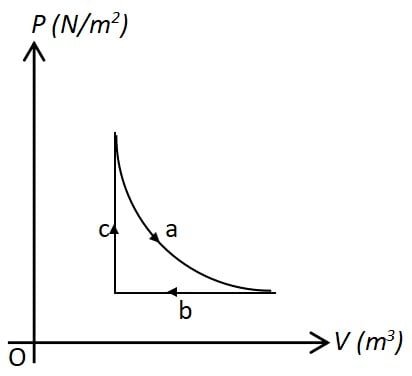
Perhatikan grafik berikut!
Suatu gas ideal mengalami proses termodinamika seperti pada grafik. Pernyataan yang tepat untuk menjelaskan proses pada grafik adalah …
A. Pada proses a, suhu berubah beraturan dan terjadi perubahan energi dalam.
B. Pada proses a, suhu konstan dan tidak terjadi perubahan energi dalam
C. Pada proses b, tekanan konstan, gas mengalami kompresi dan usaha bernilai positif.
D. Pada proses b, tekanan konstan, gas mengalami ekspansi dan usaha bernilai negatif.
E. Pada proses c, volume berubah beraturan dan gas mengalami kompresi.
Pembahasan:
Grafik pada memuat tiga proses termodinamika yang meliputi proses isobarik isokhorik isotermik. Dari grafik yang diberikan dapat diketahui bahwa a adalah proses isotermik, b adalah proses isobar, dan c adalah proses isokhorik.
Bentuk grafik pada proses a berbentuk kurva lengkung yang menunjukkan bahwa terjadi proses isotermik. Di mana, pada proses tersebut memiliki proses dengan suhu konstan. Tidak adanya perubahan suhu pada proses tersebut menunjukkan bahwa tidak adanya perubahan energi dalam.
Proses b disebut proses isobarik yang ditunjukkan dari bentuk grafik berupa garis horizontal. Pada proses isobarik, besar tekanan konstan. Grarfik menujukkan bahwa Vakhir < Vawal yang berarti Jika terjadi kompresi di mana usaha bernilai negatif.
Proses c adalah proses isokhorik yang ditunjukkan dari bentuk grafik berupa garis vertikal. Pada proses isokhorik, besar volume konstan dan usaha bernilai nol.
Jadi, pernyataan yang tepat untuk menjelaskan proses pada grafik adalah pada proses b, tekanan konstan, gas mengalami kompresi dan usaha bernilai positif.
Demikianlah tadi ulasan 4 macam proses termodinamika yang meliputi isobarik isokhorik isotermik dan adiabatik. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: