Suatu larutan dapat bersifat asam, basa, atau netral. Ada tiga penjelesan mengenai larutan asam basa dalam bahasan kimia. Tiga konsep teori asam basa diterangkan oleh Arrhenius, Bronsted-Lowry, dan Lewis. Ketiga teori ini menjelaskan pengertian larutan asam dan basa dengan cara yang berbeda.
Secara ringkas, larutan asam/basa menurut Arrheinus didasarkan pada terbentuknya ion H+ atau ion OH– dalam air. Untuk teori asam/basa menurut Bronsted-Lowry didasarkan pada peran senyawa sebagai donor proton atau akseptor proton. Sedangka teori asam/basa Lewsi menerangkan sifat teori asam basa melalui transfer pasangan elektron bebas (peb).
Baca Juga: Pemekatan/Pengenceran Larutan pada Pencapuran 2 Larutan Berbeda Konsentrasi
Bagaimana penjelasan teori asam basa dari tokoh-tokoh tersebut? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Teori Asam Basa Arrheinus
Teori asam basa menurut Arrheinus dilihat dari ionisasi senyawa ketika larut dalam air. Menurut Arrheinus, asam adalah senyawa yang mengionisasi dalam air dan memberikan ion H+ dan ion negatif. Sedangkan basa adalah senyawa yang mengionisasi dalam air untuk memberikan ion OH– dan ion positif.
Sebagai contoh, hidrogen klorida adalah asam karena dapat mengionisasi ketika larut dalam air. Hasil ionisasi menghasilkan ion hidrogen (H+) dan klorida (Cl-). Sedangkan natrium hidroksida adalah basa menurut Arrhenius karena dapat memisahkan diri dalam air untuk memberikan ion hidroksida (OH-) dan natrium (Na+).

Contoh senyawa asam:
1) Asam nitirit (HNO2): HNO2(aq)→ H+(aq) + NO2–(aq)
2) Asam sulfat (H2SO4): H2SO4(aq)→ 2H+(aq) + 2SO42–(aq)
3) Asam fosfat (H3PO4): H3PO4(aq)→ 3H+(aq) + PO43–(aq)
Contoh senyawa basa:
1) Kalium hidroksida (KOH): KOH(aq) → K+(aq) + OH–(aq)
2) Karbon hidroksida (Ca(OH)2): Ca(OH)2(aq) → Ca2+(aq) + 2OH–(aq)
Dari teori asam basa menurut Arrheinus dapat disimpulkan ciri umum asam dalam pelarut air ditandai kemampuan membentuk hidrogen bermuatan positif (H+). Sedangkan senyawa basa dalam air akan terionisasi menghasilkan ion OH–.
Nyatanya, tidak semua senyawa dengan rumus kimia yang memiliki gugus hidroksida (OH) termasuk golongan basa. Misalnya CH3COOH (asam cuka) dan Na2CO3 (natrium karbonat). Ringkasnya, teori asam basa Arrheinus memiliki kekurangan.
Kekurangan teori asam basa menurut Arrhenius:
- Hanya dapat diaplikasikan dalam reaksi yang terjadi dalam air
- Tidak menjelaskan mengapa beberapa senyawa yang mengandung hidrogen dengan bilangan oksidasi +1 (seperti HCl) larut dalam air membentuk larutan asam sedangkan yang lain seperti CH4 tidak membentuk larutan asam.
- Tidak dapat menjelaskan mengapa senyawa yang tidak memiliki OH– seperti Na2CO3 memiliki karakteristik seperti basa.
Teori Asam Basa Bronsted dan Lowry (Asam Basa Konjugasi)
Pada tahun 1923 Johanes N. Bronsted dan Thomas Lowry mengemukakan teori asam dan basa yang didasarkan pada adanya serah/terima proton. Di mana, asam adalah senyawa yang dapat memberikan proton (H+) kepada senyawa lain (donor proton). Sedangkan basa adalah senyawa yang menerima proton (H+) dari senyawa lain (akseptor proton).
Konsep asam basa menurut Bronsted dan Lowry:
- Asam: senyawa yang dapat memberikan proton kepada senyawa lain (donor proton).
- Basa: senyawa yang dapat menerima proton dari senyawa lain (akseptor proton).
Teori asam basa menurut Bronsted-Lowry dapat menjelaskan reaksi asam-basa dalam pelarut lain yang tidak menggunakan air sebagai pelarut dan pada fase gas. Sebagai contoh adalah reaksi antara HCl (asam) dan NH3 (basa).
Pada reaksi antara HCl dan NH3, HCl adalah asam karena memberikan proton (H+) kepada NH3 sehingga menjadi Cl–. Sedangkan NH3 adalah basa karena menerima proton (H+) sehingga menjadi NH4+.

Dari persamaan reaksi tersebut, ion Cl– merupakan basa konjugasi dari HCl karena kekurangan 1 proton (H+) dibandingan zat pereaksi (asal). Sedengkan NH4+ merupakan asam konjugasi dari NH3 karena kelebihan 1 proton (H+) dari zat pereaksi (asal).
Antara HCl dengan Cl– dan NH3 dengan NH4+ disebut sebagai pasangan asam basa konjugasi.
Baca Juga: Apa Itu Kesetimbangan Kimia?
Teori Asam/Basa Lewis
Gilbert Newton Lewis, seorang ahli kimia dari Amerika Serikat, memperkenalkan teori asam basa melalui transfer pasangan elektron bebas (peb). Teori asam basa Lewsi dapat digunakan untuk klasifikasi asam/basa pada artikel ion atau molekul yang tidak mempunyai atom hidrogen atau proton.
Pengertian asam-basa menurut Lewis:
- Asam: molekul atau ion yang menerima pasangan elektron bebas (akseptor peb)
- Basa: molekul atau ion yang memberikan pasangan elektronnya (donor peb)
Teori asam basa Lewis dapat digambarkan melalui struktur Lewis. Di mana, struktur Lewis menggambarkan jenis ikatan-ikatan dari elektron valensi (terluar) antar atom pada suatu molekul.
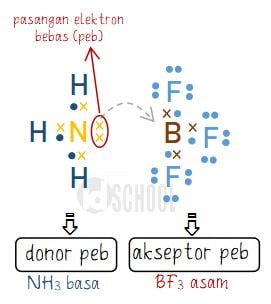
Sebagai contoh reaksi antara Boron Triflourida (BF3) dan amonia (NH3). Molukul yang bersifat asam menurut teori Lewis adalah BF3 karena dapat menerima (akseptor) pasangan elektron bebas dari NH3. Sedangkan NH3 berdasarkan teori asam basa Lewsi merupakan basa karena bertindak sebagai donor pasangan elektron bebas.
Dari struktur Lewis di atas dapat diketahui bahwa NH3 memberikan peb kepada molekul BF3. Sehingga NH3 bertindak sebagai donor peb dan BF3 bertidak sebagai akseptor peb. Maka berdasar teori Lewis, NH3 adalah basa dan BFs adalah sama.
Teori asam basa Lewis memiliki beberapa keunggulan seperti berikut.
- Dapat menjelaskan sifat asam/basa dalam pelarut lain, atau tidak mempunyai pelarut.
- Dapat menjelaskan sifat asam basa molekul atau ion yang mempunyai pasangan elektron bebas
- Mampu menerangkan sifat basa dari zat-zat organik seperti DNA dan RNA yang mengandung atom nitrogen dengan pasangan elektron bebas.
Demikianlah tadi ulasan teori asam basa yang disampaikan oleh Arrheinus, Bronsted-Lowry, dan Lewis. Terimakasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Rumus q Reaksi dan Hubungannya dengan Perubahan Entalpi (ΔH)