Konfigurasi elektron memiliki hubungan yang erat dengan jumlah elektron pada setiap kulit dan/atau sub kulit atom. Di mana jumlah elektron pada kulit dan subkulit memberikan informasi letak golongan dan periode suatu atom. Ada 2 cara yang dapat digunakan untuk menentukan golongan dan periode suatu atom dari konfigurasi elektron suatu atom. Kedua cara untuk menentukan golongan dan periode suatu atom berdasarkan bentuk atau model konfigurasi elektron.
Diketahui ada dua cara yang digunakan untuk melakukan konfigurasi elektron yaitu model Bohr dan mekanikan kuantum (sub kulit). Sehingga kedua cara menentukan golongan dan periode suatu atom menyesuaikan kedua model konfigurasi tersebut.
Konfigurasi elektron Bohr memiliki bentuk yang lebih sederhana dibanding model mekanika kuantum. Namun penentuan letak golongan dan periode suatu atom lebih tepat saat menggunakan model konfigurasi elektron mekanika kuantum.
Konfigurasi elektron model Bohr memiliki kelemahan yaitu tidak dapat digunakan untuk menentukan letak atom pada golongan A atau golongan B.

Baca Juga: Ciri Khas Atom Karbon (C)
Bagaimana cara menentukan golongan dan periode suatu atom dari konfigurasi elektron? Sobat idschcool dapat mencari tahu jawabannya bagaimana cara menentukan golongan dan periode suatu atom berdasarkan konfigurasi elektron melalui ulasan di bawah.
Table of Contents
- Mengenal Periode dan Golongan pada Tabel Sistem Periodik Unsur
- Contoh Cara Menentukan Golongan dan Periode Suatu Atom
Mengenal Periode dan Golongan pada Tabel Sistem Periodik Unsur
Sebuah tabel Sistem Periodik Unsur (SPU) disusun berdasarkan kenaikan nomor atom dan kemiripan sifat. Lajur horizontal pada tabel sistem periodik unsur disebut sebagai periode. Sedangkan lajur vertikal pada tabel sistem periodik unsur disebut golongan.
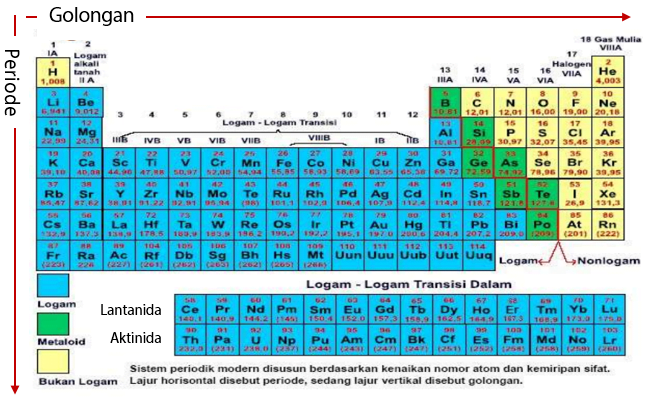
Dalam susunan tabel periodik unsur terdapat kumpulan atom atau unsur yang berada dalam susunan periode dan golongan. Jenis golongan yang berada pada tabel sistem periodik unsur meliputi golongan A (unsur utama) dan golongan B (unsur transisi). Selain itu juga ada logam-logam transisi dalam yang meliputi Lantanida dan Aktinida yang merupakan golongan unsur transisi dalam.
Letak periode dan golongan suatu atom dapat diketahui melalui konfigurasi elektron dengan memanfaatkan informasi nomor atom. Di mana nomor atom merupakan bilangan yang sama untuk menyatakan jumlah elektron pada atom tersebut.
Baca Juga: Cara Menentukan Jumlah Proton Neutron Elektron pada Suatu Atom
Contoh Cara Menentukan Golongan dan Periode Suatu Atom
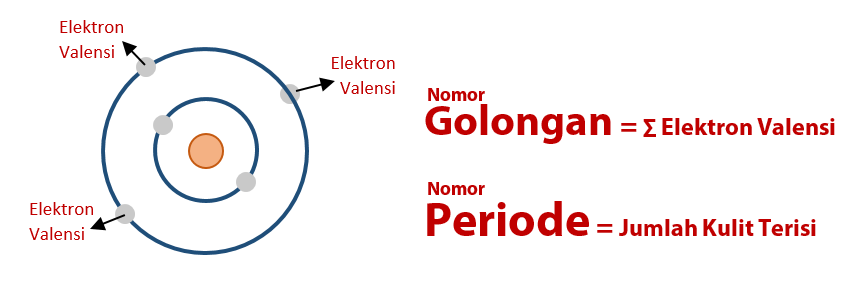
Golongan suatu atom ditunjukkan melalui kulit dan/atau sub kulit yang ditempati oleh elektron valensi (elektron terakhir yang menempati kulit/sub kulit atom) atau elektron terluar. Sementara jumlah kulit atom yang ditempati elektron menunjukkan periode atom.
Baca Juga: Susunan Atom – Proton Neutron Elektron
Contoh-contoh soal berikut akan membantu sobat idschool dalam memahami cara menentukan golongan dan periode suatu atom berdasarkan konfigurasi elektron dari suatu atom.
Golongan dan Periode Suatu Atom dari Konfigurasi Elektron Model Bohr
Contoh 1:
Tentukan letak golongan dan periode atom Litium (Li) dengan nomor atom 3.
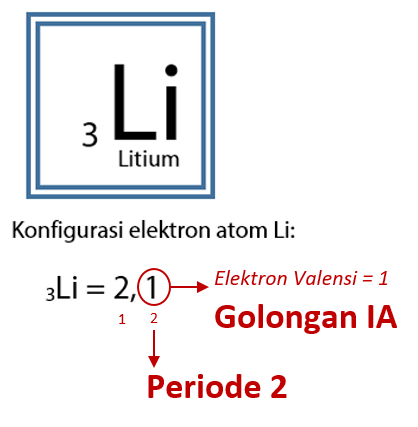
Melalui konfigurasi model atom Bohr diperoleh hasil konfigurasi elektron untuk atom Li adalah 3Li = 2, 1. Elektron valensi untuk konfigurasi elektron Li adalah 1 sehingga atom Li terletak pada golongan I. Elektron valensi mengisi kulit n = 2 (kulit L) sehingga letak periode atom Li berada pada periode 2.
Konfigurasi elektron model Bohr terlihat sederhana, namun memiliki kelemahan karena tidak dapat menentukan suatu atom memiliki jenis golongan A atau golongan B. Sehingga perlu model lain dalam menentukan periode dan golongan suatu atom.
Baca Juga: Konfigurasi Elektron Model Bohr dan Mekanika Kuantum
Golongan dan Periode Suatu Atom dari Konfigurasi Sub Kulit
Cara menentukan letak golongan dan periode suatu atom dengan model mekanika kuantum memiliki hasil yang baik. Hasil yang diperoleh dapat menentukan letak golongan baik untuk golongan A (unsur utama), golongan B (unsur transisi), atau unsur transisi dalam. Begitu juga dengan letak periode suatu atom.
Periode suatu atom ditunjukan oleh nilai bilangan kuantum utama (n) yang ditempati elektron terakhir atau nilai n paling besar dari konfigurasi sub kulit. Sedangkan cara menentukan golongan atom dengan konfigurasi sub kulit dilakukan dengan memerhatikan sub kulit terakhir yang ditempati oleh elektron.
- Elektron valensi pada sub kulit s atau p → golongan A (unsur utama)
- Elektron valensi pada sub kulit d → golongan B (unsur transisi)
- Elektron valensi pada sub kulit f → unsur transisi dalam (Lantanida dan Aktanida)
Penjelasan mengenai cara menentukan golongan dan periode suatu atom dengan konfigurasi sub kulit dijelaskan lebih banyak melalui ulasan di bawah.
1) Elektron Valensi pada Sub Kulit s atau p
Unsur-unsur dengan pengisian elektron berakhir pada subkulit s atau subkulit p masuk dalam golongan A. Konfigurasi elektron untuk unsur utama biasanya memiliki bentuk nsx atau ns2 npy.
Untuk atom dengan konfigurasi elektron yang berakhir pada nsx terletak pada golongan xA dan periode n. Untuk atom dengan konfigurasi elektron yang berakhir pada ns2 npy terletak pada golongan (2 + y)A dan periode n. Bentuk umum nomor golongan dan elektron valensi dari atom pada unsur utama sesuai dengan kondisi pada tabel berikut.
| Nomor Golongan | Elektron Valensi | Nama Golongan |
| IA | ns1 | Alkali |
| IIA | ns2 | Alkali tanah |
| IIIA | ns2 np1 | Boron – Al |
| IVA | ns2 np2 | Karbon |
| VA | ns2 np3 | Nitrogen |
| VIA | ns2 np4 | Oksigen |
| VIIA | ns2 np5 | Halogen |
| VIIIA | ns2 np6 | Gas mulia |
Contoh 2:
Tentukan letak gologan dan periode dari Magnesium (nomor atom = 12)!
- Konfigurasi elektron: 12Mg = 1s2 2s2 2p6 3s2
- Elektron valensi berada pada sub kulit s artinya Mg berada pada golongan A.
- Banyak elektron valensi pada sub kulit s = 2 elektron artinya berada pada golongan II (golongan dua)
- Elektron valensi terdapat pada kulit terluar dengan nilai n = 3, artinya Mg berada pada periode 3
- Kesimpulan: Mg berada di golongan IIA periode 3
2) Elektron Valensi pada Sub Kulit d
Konfigurasi sub kulit dengan elektron valensi pada sub kulit d memberikan informasi bahwa atom terletak pada golongan B. Konfigurasi elektron untuk unsur transisi pada umumnya akan berakhir pada nsx (n-1)dz. Di mana n adalah periode atom dan x + z adalah nomor golongan dengan pengecualian berikut.
- Untuk x + z = 8, 9, dan 10 → golongan VIIIB
- Untuk x + z = 11 → golongan IB
- Untuk x + z = 12 → golongan IIB
Golongan dan periode suatu atom dengan konfigurasi sub kulit secara umum diberikan seperti informasi pada tabel berikut.
| Nomor Golongan | Elektron Valensi |
| IIIB | ns2 (n-1)d1 |
| IVB | ns2 (n-1)d2 |
| VB | ns2 (n-1)d3 |
| VIB | ns2 (n-1)d4 |
| VIIB | ns2 (n-1)d5 |
| VIIIB | ns2 (n-1)d6 |
| VIIIB | ns2 (n-1)d7 |
| VIIIB | ns2 (n-1)d8 |
| IB | ns2 (n-1)d9 |
| IIB | ns2 (n-1)d10 |
Contoh 3: Tentukan golongan dan periode atom Cu (nomor atom = 29)!
- Konfigurasi elektron: 29Cu = 1s2 2s2 2p6 3s2 3p6 4s1 3d10
- Elektron valensi berada pada sub kulit d artinya Cu berada pada golongan B
- Konfigurasi elektron berada pada 4s1 3d10 sehingga jumlah x + z = 1 + 10 = 11, artinya Cu berada pada golongan I (golongan satu)
- Elektron valensi terdapat pada kulit terluar dengan nilai n = 4, artinya Cu berada pada periode 4
- Kesimpulan: Cu berada di golongan I B periode 4
3) Elektron Valensi pada Sub Kulit f
Jika konfigurasi elektron berakhir pada sub kulit f maka unsur berada pada Lantanida (golongan IIIB periode 6) dan Aktinida (golongan IIIB periode 7).
- Lantanida: berakhir di 4f (nomor atom 58 – 71)
- Aktinida: berakhir di 5f (nomor atom 90 – 103)
Demikianlah ulasan materi terkait cara menentukan golongan dan periode suatu atom dari konfigurasi elektron Bohr dan Mekanika Kuantum. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat.
Baca Juga: Isotop Isobar Isoton

Bisa kamu pertanggungjawabkan dengan pembahasan yang sama untuk Rhodium ?
Halo Bambang, untuk Rhodium (Rh) memiliki nomor atom = 45 sehingga memiliki konfigurasi elektron: 1s^2 2s^2 2p^6 3s^2 3p^6 3d^10 4s^2 4p^6 5s^1 4d^8.
Terima kasih kunjungan dan komentarnya, salam sukses selalu!