Deret volta adalah urutan logam-logam yang pengurutannya berdasarkan nilai potensial elektoroda standar. Di mana, urutan logam-logam dalam deret volta semakin ke kiri memiliki sifat mudah mengalami oksidasi (sebagai reduktor kuat). Sedangkan urutan logam-logam dalam deret volta semakin ke kanan memiliki sifat mudah mengalami reduksi (sebagai oksidator kuat). Sehingga dapat dikatakan bahwa, karakteristik deret volta dari kiri ke kanan adalah logam-logam dengan reduktor terkuat sampai reduktor terlemah.
Reduktor atau pereduksi adalah unsur/senyawa yang mengalami oksidasi yang ditandai dengan adanya penurunan bilangan oksidasi melalui penangkapan elektron. Besar gaya gerak listrik atau voltage/tegangan dari suatu sel yang dibangun dari dua elektroda dinyatakan melalui nilai potensial sel (Eo sel). Suatu reaksi kimia dapat berlangsung jika memiliki nilai potensial sel positif (Eo sel > 0).
Baca Juga: Diagram Sel Volta Beserta Rumus dan Keterangan Reaksinya
Bagaimana jika tidak mengetahui nilai Eo sel, apakah masih bisa mengetahui suatu reaksiakan berlangsung atau tidak? Tentu saja bisa. Fungsi dari deret volta adalah untuk mengetahui reaksi berlangsung atau tidak tanpa harus mengetahui besar Eo sel.
Bagaimana karakteristik dari logam-logam pada deret volta? Bagaimana cara menggunakan deret volta? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Urutan Unsur pada Deret Volta
- Penggunaan Karakteristik Logam pada Deret Volta Semakin ke Kiri/Kanan
- Contoh Soal dan Pembahasan
Urutan Unsur pada Deret Volta
Logam-logam pada deret volta urut berdasarkan nilai potensial sel reduksi setengah reaksinya. Besar potensial reduksi standar Eo = 0,000 terdapat pada reaksi 2H+ (aq) + 2e → H2 (g). Pada deret volta, nilai potensial reduksi standar (Eo) dari kiri ke kanan memiliki nilai dari kecil ke besar.
Logam-logam deret volta dengan nilai potensial sel di bawah air (H2O) meliputi litium (Li), kalium (K), barium (Ba), kalsium (Ca), natrium (Na), magnesium (Mg), alumunium (Al), dan mangan (Mn).
Logam-logam dengan nilai potensial sel antara nilai potensial air (H2O) dan hidrogen (H) antaran lain seng/zink (Zn), kromium (Cr), besi/ferrum (Fe), kadmium (Cd), kobalt (Co), nikel (Ni), timah/stannum (Sn), dan timbal/plumbum (Pb).
Sedangkan logam-logam dengan nilai potensial sel yang lebih besar dari potensial sel reduksi standar H adalah antimon/stibium (Sb), bismut (Bi), tembaga/cuprum (Cu), raksa/hydrargyrum (Hg), perak/argentum (Ag), platina (Pt), dan emas /aurum(Au).
Urutan logam-logam pada deret volta:
Li ‒ K ‒ Ba ‒ Ca ‒ Na ‒ Mg ‒ Al ‒ Mn ‒ [H2O] ‒ Zn ‒ Cr ‒ Fe ‒ Cd ‒ Co ‒ Ni ‒ Sn ‒ Pb ‒ [H] ‒ Sb ‒ Bi ‒ Cu ‒ Hg ‒ Ag ‒ Pt ‒ Au
Jembatan Keledai:
Lihatlah Kalau Bapak Caesar Nanti Meninggal Alam Mana ada Air(H2O) ‒ Zaman K[C]erajaan Fer’aun Cerdik Cocok Nabi Sulaeman Pemberantas buta Huruf ‒ Sambel Bibi Cukup Hangus Agak Pait Auww!!
Deret Volta semakin ke kiri, logam-logam pada deret tersebut memiliki sifat semakin mudah dioksidasi atau menjadi reduktor yang kuat. Deret Volta semakin ke kanan, logam-logam pada deret tersebut memiliki sifat semakin mudah direduksi.
Baca Juga: Cara Menentukan Reaksi yang Terjadi di Katoda/Anoda pada Sel Elektrolisis
Penggunaan Karakteristik Logam pada Deret Volta Semakin ke Kiri/Kanan
Sifat logam pada deret volta adalah logam kiri dapat mendesak/bereaksi/mengendapkan/mereduksi ion logam disebelah kanan.
Sebagai contoh seng (Zn) dengan senyawa tembaga (II) sulfat atau CuSO4 dapat bereaksi membentuk seng sulfat dan logam tembaga. Di mana pada reaksi tersebut terjadi perubahan bilagan oksidasi yang biasa disebut reaksi redoks. Contoh lain, reaksi antara tembaga dengan seng sulfat tidak terjadi reaksi.
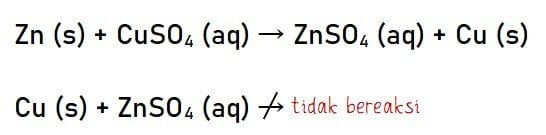
Penjelasan dari contoh pertama, logam Zn dalam deret volta berada disebelah kiri dari logam Cu. Sehingga, logam Zn akan mendesak ion logam Cu dan membentuk senyawa seng sulfat (ZnSO4).
Pada contoh kedua, logam Cu dalam deret volta terletak di sebelah kanan logam Zn. Sehingga, logam Cu tidak bisa mendesak/mereduksi ion logam Zn yang mengakibatkan tidak terjadinya reaksi.
Baca Juga: Persamaan/Perbedaan Sel Elektrolisis dan Sel Volta
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan di atas. Setiap contoh soal yang diberikan dilengkapi dengan pembahasannya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Penggunaan Karakteristik Deret Volta Semakin ke Kiri/Kanan
Reaksi berikut ini yang dapat berlangsung spontan adalah ….
A. Ba2+ + Zn → Ba + Zn2+
B. Fe + Cu2+ → Fe2+ + Cu
C. Mn2+ + Zn → Mn + Zn2+
D. Ca2+ + Ni → Ca + Ni2+
E. Mg2+ + Fe2+ → Mg + Fe3+
Pembahasan:
Logam di sebelah kanan pada deret volta akan lebih mudah mengalami reduksi dan logam di sebelah kiri akan lebih mudah mengalami oksidasi. Reaksi redoks akan berlangung spontan jika logam yang terletak di sebelah kanan ditempatkan sebagai katode dan logam di sebelah kiri sebagai anode. Atau, dari persamaan reaksi dilihat dari logam berada di sebelah kiri dan ion logam di sebelah kanan pada sel volta.
Deret volta:
Li ‒ K ‒ Ba ‒ Ca ‒ Na ‒ Mg ‒ Al ‒ Mn ‒ [H2O] ‒ Zn ‒ Cr ‒ Fe ‒ Cd ‒ Co ‒ Ni ‒ Sn ‒ Pb ‒ [H] ‒ Sb ‒ Bi ‒ Cu ‒ Hg ‒ Ag ‒ Pt ‒ Au
Lihat kembali posisi logam dan ion logam dari reaktan pada persamaan reaksi di pilihan yang diberikan
A) Zn (kanan) + Ba2+ (kiri)
B) Fe (kiri) + Cu2+ (kanan)
C) Zn (kanan) + Mn2+ (kiri)
D) Ni (kanan) + Ca2+ (kiri)
E) Mg2+ (kiri) + Fe2+ (kanan), namun keduanya berupa ion logam
Diperoleh reaksi dengan logam berada di posisi lebih kiri dibanding ion logam terdapat pada reaksi Fe + Cu2+ → Fe2+ + Cu. Jadi, reaksi berikut ini yang dapat berlangsung spontan adalah Fe + Cu2+ → Fe2+ + Cu.
Jawaban: B
Contoh 2 – Penggunaan Karakteristik Deret Volta Semakin ke Kiri/Kanan

Pembahasan:
Reaksi redoks akan berlangung spontan jika logam yang terletak lebih kanan ditempatkan sebagai katode dan logam yang terletak lebih di sebelah kiri sebagai anode. Pada notasi diagram sel volta dituliskan dengan anoda di sebelah kiri (pertama) dan katoda di sebelah kanan (kedua).
Sehingga reaksi spontan terdapat pada notasi sel volta dengan logam pertama terletak (dalam deret volta) lebih kiri dari logam kedua.
Deret volta:
Li ‒ K ‒ Ba ‒ Ca ‒ Na ‒ Mg ‒ Al ‒ Mn ‒ [H2O] ‒ Zn ‒ Cr ‒ Fe ‒ Cd ‒ Co ‒ Ni ‒ Sn ‒ Pb ‒ [H] ‒ Sb ‒ Bi ‒ Cu ‒ Hg ‒ Ag ‒ Pt ‒ Au
- Ag terletak di sebelah kanan Cr
- Ag terletak di sebelah kanan Zn
- Cr terletak di sebelah kanan Al
- Zn terletak di sebelah kanan Al
- Zn terletak di sebelah kiri Ag
Jadi, diagram sel yang dapat berlangsung spontan adalah Zn|Zn2+ || Ag+|Ag.
Jawaban: E
Contoh 3 – Penggunaan Karakteristik Deret Volta Semakin ke Kiri/Kanan
Diketahui beberapa potensial reduksi sebagai berikut.
Au3+ (aq) + 3e → Au (s) Eo = +1,52 Volt
Ag+ (aq) + e → Ag (s) Eo = +0,80 Volt
Sn2+ (aq) + 2e → Sn (s) Eo = ‒0,14 Volt
Cr3+ (aq) + 3e → Cr (s) Eo = ‒0,74 Volt
Reaksi yang dapat berlangsung spontan berdasarkan data tersebut adalah ….
A. Cr|C3+ || Sn2+|Sn
B. Ag|Ag+ || Cr3+|Cr
C. Au|Au3+ || Ag+|Ag
D. Sn|Sn2+ || Cr3+|Cr
E. Ag|Ag+ || Sn2+|Sn
Pembahasan:
Reaksi spontan terdapat pada notasi sel volta dengan logam pertama yang dituliskan terletak (dalam deret volta) lebih kiri dari logam kedua.
Deret volta:
Li ‒ K ‒ Ba ‒ Ca ‒ Na ‒ Mg ‒ Al ‒ Mn ‒ [H2O] ‒ Zn ‒ Cr ‒ Fe ‒ Cd ‒ Co ‒ Ni ‒ Sn ‒ Pb ‒ [H] ‒ Sb ‒ Bi ‒ Cu ‒ Hg ‒ Ag ‒ Pt ‒ Au
- Cr terletak di kiri Sn
- Ag terletak di kanan Cr
- Au terletak di kanan Ag
- Sn terletak di kanan Cr
- Ag terletak di kanan Sn
Jadi, diagram sel yang dapat berlangsung spontan adalah Cr|C3+ || Sn2+|Sn.
Jawaban: A
Demikianlah tadi ulasan bagaimana karakteristik deret volta semakin ke kiri dan bagaimana kaarakteristik deret volta semakin ke kanan. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Daftar Apa Saja Larutan Elektrolit Kuat dan Apa Saja Larutan Elektrolit Lemah


