Titrasi adalah teknik analisis untuk menentukan konsentrasi suatu larutan asam/basa. Hubungan antara perkalian konsentrasi larutan dengan valensi asam/basa dinyatakan melalui rumus titrasi asam basa. Sobat idschool dapat menentukan konsentrasi larutan asam/basa melalui proses titrasi. Caranya dilakukan dengan menggunakan indikator asam/basa dan larutan asam/basa yang telah diketahui konsentrasinya. Prinsip kerja dari titrasi asam basa berdasarkan pada reaksi netralisasi yaitu reaksi larutan asam dan basa yang menghasilkan garam dan air.
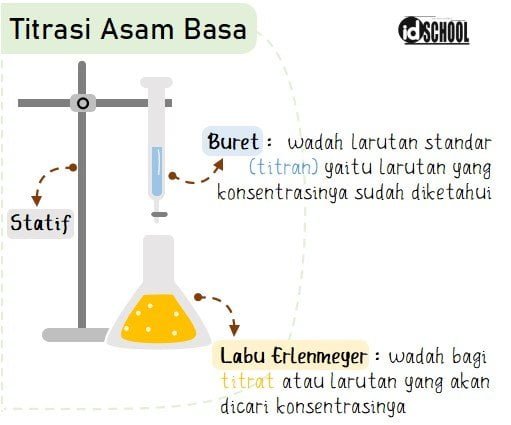
Proses titrasi mengunakan labu erlemeyer, buret, serta penyangga buret (statis dan klem). Labu erlenmeyer berisi titrat yaitu larutan yang belum diketahui konsentrasinya dan akan dianalisis untuk mengetahui besar konsentrasi larutan tersebut. Buret merupakan wadah untuk titran yaitu larutan standar yang telah diketahui konsentrasinya. Gambaran proses titrasi asam basa ditunjukkan seperti gambar berikut.
Baca Juga: Perhitungan pada Pengenceran/Pemekatan 2 Campuran dengan Konsentrasi yang Berbeda
Bagaimana berlangsungnya proses titrasi? Apa saja rumus titrasi asam basa? Bagaimana bentuk kurva titrasi asam basa? Sobat idschool dapat mencari tahu jawabannya melalui ulasan di bawah.
Table of Contents
- Proses Titrasi Asam Basa
- Rumus Titrasi Asam Basa
- Bentuk Kurva Titrasi Asam Basa
- Contoh Soal dan Pembahasan
Proses Titrasi Asam Basa
Misalnya pada titrasi HCl dengan NaOH menggunaakan indikator fenoltein (pp). Larutan HCl ditempatkan pada labu erlenmeyer yang berlaku sebagai titrat. Ke dalam titrat ditambahkan indikator fenolptalein (pp) yang dapat berubah warna menjadi merah muda (pink). Penambahan indikator pada titrat berfungsi sebagai penunjuk kapan titik akhir dari proses titrasi. Pada buret ditempatkan larutan NaOH dengan konsentrasi tertentu yang berlaku sebagai titran.
Selanjutnya, proses titrasi dilakukan dengan membuka kran pada buret sehigga memungkinkan NaOH menetes dan jatuh ke HCl pada tabung erlenmeyer. Selama proses tritasi perlu menggoyang-goyang tabung erlenmeyer untuk membantu larutan bercampur dengan baik.
Proses tritasi dihentikan saat larutan berubah warna sesuai dengan indikator yang digunakan. Pada penggunaan indikator fenolptalein, larutan akan berubah menjadi warna merah muda (pink).

Proses titrasi mengupayakan titik akhir titrasi mendekati titik ekivalen yaitu saat mol asam sama dengan mol basa atau saat asam dan basa tepat habis bereaksi. Hasil dari proses titrasi akan diperoleh titik ekivalen yang ditunjukkan oleh adanya perubahan warna indikator (titik akhir titrasi).
Baca Juga: Rumus pada Kelarutan (s) dan Hasil Kali Kelarutan (Ksp)
Rumus Titrasi Asam Basa
Rumus titrasi asam basa merupakan persamaan perkalian antara valensi asam dan jumlah mol larutan asam dengan valensi basa dan jumlah mol larutan basa.
Dari persamaan rumus titrasi tersebut kemudian dapat diturunkan dua bentuk rumus titrasi asam basa. Pertama adalah rumus titrasi asam basa dengan merubah persamaan jumlah mol sama dengan perkalian konsentrasi dan volume. Kedua adalah rumus titrasi dengan merubah persamaan jumlah mol sama dengan pembagian massa dengan jumlah molekul relatif (Mr).
Kumpulan rumus titrasi asam basa sesuai dengan tiga persamaan berikut.
Contoh penggunaan rumus titrasi asam basa ditunjukkan seperti pada penyelesaian cara berikut.
Soal:
Larutan H2SO4 Sebanyak 20 mL dititrasi dengan NaOH 0,1 M menggunakan indikator fenolptalein. Jika pada akhir titrasi diperlukan volume NaOH sebesar 30 mL maka berapakah molaritas H2SO4?
Penyelesaian:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Titrat: H2SO4 (valensi asam: a = 2)
- Titran: NaOH (valensi basa: b = 1)
- Volume asam: Va = 20 mL
- Volume basa: Vb = 30 mL
- Konsentrasi basa: Mb = 0,1 M
Tanya: Konsentrasi/Molaritas H2SO4 (Ma)?
Jawab:
Menentukan konsentrasi larutan H2SO4:
a × Ma × Va = b × Mb × Vb
2 × Ma × 20 = 1 × 0,1 × 30
40 Ma = 3
Ma = 3/40 = 0,075 M
Baca Juga: Perhitungan pada Sel Elektrolisis
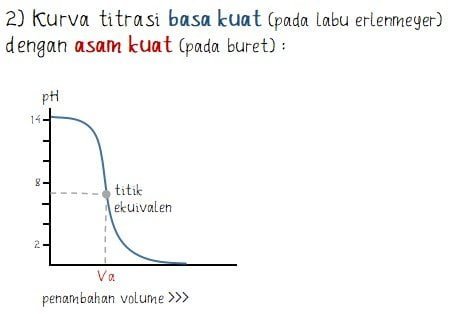
Bentuk Kurva Titrasi Asam Basa
Kurva titrasi asam basa menunjukkan hubungan perubahan pH yang terjadi terhadap penambahan volume larutan asam/basa. Perubahan pH ditunjukkan pada sumbu vertikal (sumbu tegak) atau sumbu y, sedangkan penambahan volume pada sumbu horizontal (sumbu datar) atau sumbu x. Bentuk kurva bergantung dari jenis larutan asam/basa kuat/lemah yang bertindak sebagai titrat dan titran.
Empat bentuk kurva titrasi ditunjukkan seperti berikut.



Baca Juga: Cara Menghitung dan Rumus pH Campuran Larutan Asam/Basa
Contoh Soal dan Pembahasan
Beberapa contoh soal di bawah dapat sobat idschool gunakan untuk menambah pemahaman bahasan kurva dan rumus titrasi asam basa. Setiap contoh soal yang diberikan dilengkapi dengan pembahasan penggunaan rumus titrasi asam basa dan cara membaca kurvanya. Sobat idschool dapat menggunakan pembahasan tersebut sebagai tolak ukur keberhasilan mengerjakan soal. Selamat Berlatih!
Contoh 1 – Penggunaan Rumus Titrasi Asam Basa
Diperoleh data hasil titrasi larutan HCl dengan larutan Ba(OH)2 0,1 M sesuai pada tabel berikut.
Konsentrasi larutan HCl adalah ….
A. 0,100 M
B. 0,105 M
C. 0,210 M
D. 0,220 M
E. 0,400 M
Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi seperti berikut.
- Titran: Ba(OH)2 (basa kuat) → valensi basa: b = 2
- Konsentrasi Ba(OH)2: Mb = 0,1 M
- Volume rata-rata Ba(OH)2:
Vb = (21 + 22 + 20) : 3
Vb = 63 : 2 = 21 mL - Titrat: HCl (asam kuat) → valensi asam: a = 1
- Volume HCl: Va = 20 mL
Menghitung konsentrasi HCl (Ma):
a × Ma × Va = b × Mb × Vb
1 × Ma × 20 = 2 × 0,1 × 21
20Ma = 4,2
Ma = 4,2/20 = 0,21 M
Jadi, konsentrasi larutan HCl sama dengan 0,210 M.
Jawaban: C
Contoh 2 – Penggunaan Rumus Titrasi Asam Basa
Diketahui data beberapa indikator dan trayek pH:
Metil Jingga: 3,1 ‒ 4,40
Bromtimol biru: 6,0 ‒ 7,6
Fenolptalein: 8,3 ‒ 10,0
Berikut ini adalah kurva titrasi asam-basa.
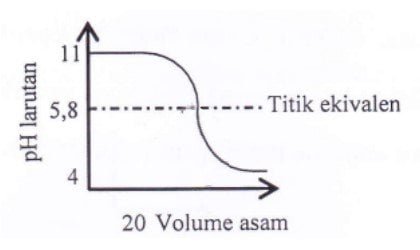
Pasangan asam-basa/basa-asam dan indikator yang digunakan berturut-turut adalah ….
A. KOH ‒ CH3COOH ‒ fenolptalein
B. KOH ‒ HCl ‒ fenolptalein
C. NH3 ‒ HCl ‒ metil jingga
D. NH4OH ‒ CH3COOH ‒ metil jingga
E. NaOH ‒ HCl ‒ fenolptalein
Pembahasan:
Dari kurva dapat diketahui bahwa perubahan pH terjadi dari larutan dengan sekitar pH = 11 (basa lemah) menjadi sekitar pH = 4 setelah penambahan asam. Sehingga dapat disimpulkan bahwa kurva merupakan hasil dari titrasi basa lemah (titrat) dengan asam kuat (titran).
Asam Kuat: HCl, H2SO4, HNO3, HBr, HI, HClO3, HClO4
Basa Lemah: CH3COOH, NH3, NH=OH, NH4OH, Fe(OH)2, Al(OH)3, (CH3)2NH, HCO3Na
Titik ekivalen pada proses titrasi asam tersebut tersebut terletak pada pH = 5,8. Sehingga indikator yang dibutuhkan adalah indikator dengan trayek pH akan berubah saat pH = 5,8. Sehingga indikator yang sesuai dengan kurva hasil titrasi asam basa tersebut adalah indikator dengan trayek 3,1 < pH < 4,40 yaitu metil hingga.
Jadi, pasangan asam-basa/basa-asam dan indikator yang digunakan berturut-turut adalah NH3 ‒ HCl ‒ metil jingga.
Jawaban: C
Baca Juga: Kumpulan Rumus Konsentrasi Larutan dan Contoh Penggunaannya
Contoh 3 – Penggunaan Rumus Titrasi Asam Basa

Pembahasan:
Berdasarkan keterangan yang diberikan pada soal dapat diperoleh informasi-informasi seperti berikut.
- Titrat: KOH (basa, valensi basa: b = 1)
- Volume KOH: Vb = 25 mL = 0,025 liter
- Mr KOH = Mr b = 56
- Titran: HCl (asam, valensi asam: a = 1)
- Konsentrasi HCl: Ma = 0,2 M
- Volume HCl: Va = 25 mL = 0,025 liter
- Indikator: fenolftalein
Massa KOH dapat dihitung seperti pada penyelesaian cara berikut.

Jadi, massa KOH sama dengan 0,28 gram.
Jawaban: E
Contoh 4 – Penggunaan Rumus Titrasi Asam Basa
Sebanyak 2 gram cuplikan NaOH (Mr = 40) dilarutkan dalam 250 mL air, kemudian 20 mL dari larutan tersebut dititrasi dengan HCl 0,1 M. Dari tiga percobaa diketahui bahwa HCl yang dibutuhkan di akhir reaksi berturut-turut adalah 24 mL, 26 mL, dan 25 mL. Kadar NaOH dalam cuplikan tersebut adalah ….
A. 20%
B. 25%
C. 40%
D. 62,5%
E. 75%
Pembahasan:
Dari keterangan yang diberikan pada soal dapat diperoleh data-data berikut.
- Massa cuplikan NaOH : Gram NaOH = 2 gram
Mr NaOH = 40
Volume untuk melarutkan cuplika NaOH = 250 mL = 0,25 liter
- Titrat = NaOH (valensi basa: b = 1 )
Volume basa: Vb = 20 mL
- Titran: HCl (volume asam: a = 1)
Konsentrasi asam: Ma = 0,1 M
Rata-rata volume asam hasil percobaan:
Va = (24 + 26 + 25) : 3
Va = 75 : 3 = 25 mL
Menghitung konsentrasi NaOH:
b × MNaOH × VNaOH = a × MHCl × VHCl
1 × MNaOH × 20 = 1 × 0,1 × 25
20 × MNaOH = 2,5
MNaOH = 2,5/20 = 0,125 M
Menghitung kadar NaOH dalam cuplikan (%NaOH):
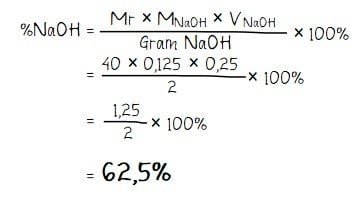
Jadi, kadar NaOH dalam cuplikan tersebut sama sengan 62,5%.
Jawaban: D
Demikianlah tadi ulasan kurva dan rumus titrasi asam basa yang disertai dengan contoh penggunaan rumus titrasi asam basa. Terima kasih sudah mengunjungi idschool(dot)net, semoga bermanfaat!
Baca Juga: Rumus Kadas Zat/Unsur dalam Senyawa + Contoh Perhitungannya